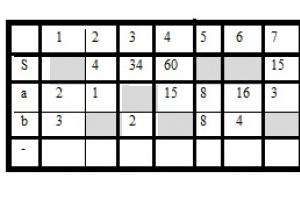
Определите, атомы каких из указанных в ряду элементов имеют на внешнем энергетическом уровне четыре электрона.
Ответ: 35
Пояснение:
Количество электронов на внешнем энергетическом уровне (электронном слое) элементов главных подгрупп равно номеру группы.
Таким образом, из представленных вариантов ответов подходят кремний и углерод, т.к. они находятся в главной подгруппе четвертой группы таблицы Д.И. Менделеева (IVA группа), т.е. верны ответы 3 и 5.
Определите, у атомов каких их указанных в ряду элементов в основном состоянии число неспаренных электронов на внешнем уровне равно 1.
Запишите в поле ответа номера выбранных элементов.
Ответ: 24
Пояснение:
Барий — элемент главной подгруппы второй группы и шестого периода Периодической системы Д. И. Менделеева, следовательно, электронная конфигурация его внешнего слоя будет 6s 2 . На внешнем 6s s -орбитали, атома бария расположено 2 спаренных электрона с противоположными спинами (полное заполнение подуровня).
Алюминий — элемент главной подгруппы третьей группы и третьего периода Периодической системы, и электронная конфигурация внешнего слоя атома алюминия — 3s 2 3p 1: на 3s -подуровне (состоит из одной s -орбитали) расположено 2 спаренных электрона с противоположными спинами (полное заполнение), а на 3p -подуровне — один неспаренный электрон. Таким образом, у алюминия в основном состоянии число неспаренных электронов на внешнем энергетическом уровне равно 1.
Азот — элемент главной подгруппы пятой группы и второго периода Периодической системы, электронная конфигурация внешнего слоя атома азота — 2s 2 2p 3 : на 2s -подуровне расположено 2 спаренных электрона с противоположными спинами, а на 2p p -орбиталей (p x , p y , p z ) — три неспаренных электрона, каждый из которых находится на каждой орбитали. Таким образом, у алюминия в основном состоянии число неспаренных электронов на внешнем энергетическом уровне равно 1.
Хлор — элемент главной подгруппы седьмой группы и третьего периода Периодической системы, электронная конфигурация внешнего слоя атома хлора — 3s 2 3p 5 : на 3s -подуровне расположено 2 спаренных электрона с противоположными спинами, а на 3p -подуровне, состоящего из трех p -орбиталей (p x , p y , p z ) — 5 электронов: 2 пары спаренных электронов на орбиталях p x , p y и один неспаренный — на орбитали p z. Таким образом, у хлора в основном состоянии число неспаренных электронов на внешнем энергетическом уровне равно 1.
Кальций — элемент главной подгруппы второй группы и четвертого периода Периодической системы Д. И. Менделеева. Электронная конфигурация его внешнего слоя схожа с электронной конфигурацией атома бария. На внешнем 4s -подуровне, состоящем из одной s -орбитали, атома кальция расположено 2 спаренных электрона с противоположными спинами (полное заполнение подуровня).
Определите, у атомов каких их указанных в ряду элементов все валентные электроны расположены на 4s -энергетическом подуровне.
Запишите в поле ответа номера выбранных элементов.
Ответ: 25
Пояснение:
s 2 3p 5 , т.е. валентные электроны хлора расположены на 3s- и 3p -подуровнях (3-ий период).
Калий — элемент главной подгруппы первой группы и четвертого периода Периодической системы, и электронная конфигурация внешнего слоя атома калия — 4s 1 , т.е. единственный валентный электрон атома калия расположен на 4s -подуровне (4-ый период).
Бром — элемент главной подгруппы седьмой группы и четвертого периода Периодической системы, электронная конфигурация внешнего слоя атома брома — 4s 2 4p 5 , т.е. валентные электроны атома брома расположены на 4s- и 4p -подуровнях (4-ый период).
Фтор — элемент главной подгруппы седьмой группы и второго периода Периодической системы, электронная конфигурация внешнего слоя атома фтора — 2s 2 2p 5 , т.е. валентные электроны атома фтора расположены на 2s- и 2p- подуровнях. Однако, ввиду высокой электроотрицательности фтора только единственный электрон, расположенный на 2p- подуровне, участвует в образовании химической связи.
Кальций — элемент главной подгруппы второй группы и четверного периода Периодической системы Д. И. Менделеева, электронная конфигурация его внешнего слоя — 4s 2 , т.е. валентные электроны расположены на 4s -подуровне (4-ый период).
Определите, у атомов каких их указанных в ряду элементов валентные электроны расположены на третьем энергетическом уровне.
Запишите в поле ответа номера выбранных элементов.
Ответ: 15
Пояснение:
Хлор — элемент главной подгруппы седьмой группы и третьего периода Периодической системы Д. И. Менделеева, электронная конфигурация внешнего слоя хлора — 3s 2 3p 5 , т.е. валентные электроны хлора расположены на третьем энергетическом уровне (3-ий период).
s 2 2p 3 , т.е. валентные электроны азота расположены на втором энергетическом уровне (2-ой период).
Углерод — элемент главной подгруппы четвертой группы и второго периода Периодической системы, электронная конфигурация внешнего слоя атома углерода — 2s 2 2p 2 , т.е. валентные электроны атома углерода расположены на втором энергетическом уровне (2-ой период).
Бериллий — элемент главной подгруппы второй группы и второго периода Периодической системы, электронная конфигурация внешнего слоя атома бериллия — 2s 2 , т.е. валентные электроны атома бериллия расположены на втором энергетическом уровне (2-ой период).
Фосфор — элемент главной подгруппы пятой группы и третьего периода Периодической системы Д. И. Менделеева, электронная конфигурация его внешнего слоя — 3s 2 3p 3 , т.е. валентные электроны атома фосфора расположены на третьем энергетическом уровне (3-ий период).
Определите, у атомов каких их указанных в ряду элементов на d -подуровнях электронов нет.
Запишите в поле ответа номера выбранных элементов.
Ответ: 12
Пояснение:
Хлор — элемент главной подгруппы седьмой группы и третьего периода Периодической системы Д. И. Менделеева, электронная конфигурация атома хлора — 1s 2 2s 2 2p 6 3s 2 3p 5 , т.е. d -подуровня у атома хлора не существует.
Фтор — элемент главной подгруппы седьмой группы и второго периода Периодической системы Д. И. Менделеева, электронная конфигурация атома фтора — 1s 2 2s 2 2p 5 , т.е. d -подуровня у атома фтора также не существует.
Бром — элемент главной подгруппы седьмой группы и четвертого периода Периодической системы Д. И. Менделеева, электронная конфигурация атома брома — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 , т.е. у атома брома существует полностью заполненный 3d -подуровень.
Медь — элемент побочной подгруппы первой группы и четвертого периода Периодической системы, электронная конфигурация атома меди — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 , т.е. у атома меди существует полностью заполненный 3d -подуровень.
Железо — элемент побочной подгруппы восьмой группы и четвертого периода Периодической системы Д. И. Менделеева, электронная конфигурация атома железа — 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 , т.е. у атома железа существует незаполненный 3d -подуровень.
Определите, атомы каких из указанных в ряду элементов относятся к s -элементам.
Запишите в поле ответа номера выбранных элементов.
Ответ: 15
Пояснение:
Гелий — элемент главной подгруппы второй группы и первого периода Периодической системы Д. И. Менделеева, электронная конфигурация атома гелия — 1s 2 , т.е. валентные электроны атома гелия расположены только на 1s -подуровне, следовательно, гелий можно отнести к s -элементам.
Фосфор — элемент главной подгруппы пятой группы и третьего периода Периодической системы Д. И. Менделеева, электронная конфигурация внешнего слоя атома фосфора — 3s 2 3p 3 , следовательно, фосфор относится к p -элементам.
s 2 3p 1 , следовательно, алюминий относится к p -элементам.
Хлор — элемент главной подгруппы седьмой группы и третьего периода Периодической системы Д. И. Менделеева, электронная конфигурация внешнего слоя атома хлора — 3s 2 3p 5 , следовательно, хлор относится к p -элементам.
Литий — элемент главной подгруппы первой группы и второго периода Периодической системы Д. И. Менделеева, электронная конфигурация внешнего слоя атома лития — 2s 1 , следовательно, литий относится к s -элементам.
Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns 1 np 2 .
Запишите в поле ответа номера выбранных элементов.
Ответ: 12
Пояснение:
Бор — элемент главной подгруппы третьей группы и второго периода Периодической системы Д. И. Менделеева, электронная конфигурация атома бора в основном состоянии — 2s 2 2p 1 . При переходе атома бора в возбужденное состояние электронная конфигурация становится 2s 1 2p 2 за счет перескока электрона с 2s- на 2p- орбиталь.
Алюминий — элемент главной подгруппы третьей группы и третьего периода Периодической системы, электронная конфигурация внешнего слоя атома алюминия — 3s 2 3p 1 . При переходе атома алюминия в возбужденное состояние электронная конфигурация становится 3s 1 3 p 2 за счет перескока электрона с 3s- на 3p- орбиталь.
Фтор — элемент главной подгруппы седьмой группы и второго периода Периодической системы Д. И. Менделеева, электронная конфигурация внешнего слоя атома фтора — 3s 2 3p 5 . В данном случае в возбужденном состоянии невозможно получить электронную конфигурацию внешнего электронного уровня ns 1 np 2 .
Железо — элемент побочной подгруппы восьмой группы и четвертого периода Периодической системы Д. И. Менделеева, электронная конфигурация внешнего слоя атома железа — 4s 2 3d 6 . В данном случае в возбужденном состоянии также невозможно получить электронную конфигурацию внешнего электронного уровня ns 1 np 2 .
Азот — элемент главной подгруппы пятой группы и второго периода Периодической системы, и электронная конфигурация внешнего слоя атома азота — 2s 2 2p 3 . В данном случае в возбужденном состоянии также невозможно получить электронную конфигурацию внешнего электронного уровня ns 1 np 2 .
Определите, для атомов каких из указанных в ряду элементов возможен переход в возбужденное состояние.
Запишите в поле ответа номера выбранных элементов.
Ответ: 23
Пояснение:
Рубидий и цезий — элементы главной подгруппы первой группы Периодической системы Д. И. Менделеева, являются щелочными металлами, у атомов которых на внешнем энергетическом уровне расположен один электрон. Поскольку s -орбиталь для атомов данных элементов является внешней, невозможен перескок электрона с s — на p -орбиталь, и следовательно, не характерен переход атома в возбужденное состояние.
Атом азота не способен переходить в возбужденное состояние т.к. заполняемым у него является 2-й энергетический уровень и на этом энергетическом уровне отсутствуют свободные орбитали.
Алюминий — элемент главной подгруппы третьей группы Периодической системы химических элементов, электронная конфигурация внешнего слоя атома алюминия — 3s 2 3p 1 . При переходе атома алюминия в возбужденное состояние происходит перескок электрона с 3s- на 3p- орбиталь, и электронная конфигурация атома алюминия становится 3s 1 3 p 2 .
Углерод — элемент главной подгруппы четвертой группы Периодической системы, электронная конфигурация внешнего слоя атома углерода — 2s 2 2p 2 . При переходе атома углерода в возбужденное состояние происходит перескок электрона с 2s- на 2p- орбиталь, и электронная конфигурация атома углерода становится 2s 1 2p 3 .
Определите, атомам каких из указанных в ряду элементов соответствует электронная конфигурация внешнего электронного слоя ns 2 np 3 .
Запишите в поле ответа номера выбранных элементов.
Ответ: 23
Пояснение:
Электронная конфигурация внешнего электронного слоя ns 2 np 3 говорит о том, что заполняемым у искомых элементов является p подуровень, т.е. это p -элементы. Все p -элементы расположены в 6-ти последних ячейках каждого периода в группе, номер которой равен сумме электронов на s и p подуровнях внешнего слоя, т.е. 2+3 = 5. Таким образом искомые элементы — азот и фосфор.
Определите, атомы каких из указанных в ряду элементов имеют сходную конфигурацию внешнего энергетического уровня.
Запишите в поле ответа номера выбранных элементов.
Ответ: 34
Среди перечисленных элементов сходную электронную конфигурацию имеют бром и фтор. Электронная конфигурация внешнего слоя имеет вид ns 2 np 5
Определите, атомы каких из указанных в ряду элементов имеют полностью завершенный второй электронный уровень.
Запишите в поле ответа номера выбранных элементов.
Ответ: 13
Пояснение:
Заполненный 2-й электронный уровень имеет благородный газ неон, а также любой химический элемент, расположенный в таблице Менделеева после него.
Определите, у атомов каких из указанных в ряду элементов для завершения внешнего энергетического уровня не достает 2 электронов.
Запишите в поле ответа номера выбранных элементов.
Ответ: 34
До завершения внешнего электронного уровня 2 электрона недостает p -элементам шестой группы. Напомним, что все p -элементы расположены в 6-ти последних ячейках каждого периода.
Определите, атомы каких из указанных в ряду элементов в возбужденном состоянии имеют электронную формулу внешнего энергетического уровня ns 1 np 3 .
Запишите в поле ответа номера выбранных элементов.
Ответ: 24
Пояснение:
s 1 np 3 говорит нам о том, что на внешнем энергетическом уровне (электронном слое) находится 4 электрона (1+3). Среди указанных элементов 4 электрона на внешнем уровне имеют только атомы кремния и углерода.
Электронная конфигурация внешнего энергетического уровня данных элементов в основном состоянии имеет вид ns 2 np 2 , а в возбужденном ns 1 np 3 (при возбуждении атомов углерода и кремния происходит распаривание электронов s-орбитали и один электрон попадает на свободную p -орбиталь).
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют электронную формулу внешнего энергетического уровня ns 2 np 4 .
Запишите в поле ответа номера выбранных элементов.
Ответ: 25
Пояснение:
Формула внешнего энергетического уровня ns 2 np 4 говорит нам о том, что на внешнем энергетическом уровне (электронном слое) находится 6 электронов (2+4). Количество электронов на внешнем электронном уровне для элементов главных подгрупп всегда равно номеру группы. Таким образом, электронную конфигурацию ns 2 np 4 среди указанных элементов имеют атомы селена и серы, так как данные элементы расположены в VIA группе.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют только один неспаренный электрон.
Запишите в поле ответа номера выбранных элементов.
Ответ: 25
Определите, атомы каких из элементов имеет конфигурацию внешнего электронного уровня ns
2 np
3 .
Ответ: 45
Определите, атомы каких из указанных в ряду элементов в основном состоянии не содержат неспаренных электронов.
Запишите в поле ответа номера выбранных элементов.
Химический элемент – определенный вид атомов, обозначаемый названием и символом и характеризуемый порядковым номером и относительной атомной массой.
В табл. 1 перечислены распространенные химические элементы, приведены символы, которыми они обозначаются (в скобках – произношение), порядковые номера, относительные атомные массы, характерные степени окисления.
Нулевая степень окисления элемента в его простом веществе (веществах) в таблице не указана.


Все атомы одного элемента имеют одно и то же число протонов в ядре и число электронов в оболочке. Так, в атоме элемента водород Н находится 1р + в ядре и на периферии 1е - ; в атоме элемента кислород О находится 8р + в ядре и 8е - в оболочке; атом элемента алюминий Аl содержит 13р + в ядре и 13е - в оболочке.
Атомы одного элемента могут различаться числом нейтронов в ядре, такие атомы называются изотопами. Так, у элемента водород Н три изотопа: водород-1 (специальное название и символ протий 1 H) с 1 р + в ядре и 1е - в оболочке; водород-2 (дейтерий 2 Н, или D) с 1р + и 1п 0 в ядре и 1е - в оболочке; водород-3 (тритий 3 Н, или Т) с 1р + и 2п 0 в ядре и 1е - в оболочке. В символах 1 Н, 2 Н и 3 Н верхний индекс указывает массовое число – сумму чисел протонов и нейтронов в ядре. Другие примеры:

Электронную формулу атома любого химического элемента в соответствии с его расположением в Периодической системе элементов Д. И. Менделеева можно определить по табл. 2.


Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3-й и т. д.), уровни делятся на подуровни (обозначаются буквами s, р, d, f ). Подуровни состоят из атомных орбиталей – областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как 1s (орбиталь 1-го уровня s-подуровня), 2s , 2р , 3s , 3р, 3d, 4s … Число орбиталей в подуровнях:
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
1) принцип минимума энергии
Электроны заполняют орбитали, начиная с подуровня с меньшей энергией.
Последовательность нарастания энергии подуровней:
1s < 2c < 2p < 3s < 3p < 4s ? 3d < 4p < 5s ? 4d < 5p < 6s …
2) правило запрета (принцип Паули)
В каждой орбитали может разместиться не более двух электронов.
Один электрон на орбитали называется неспаренным, два электрона - электронной парой:

3) принцип максимальной мультиплетности (правило Хунда)
В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем – полностью.
Каждый электрон имеет свою собственную характеристику – спин (условно изображается стрелкой вверх или вниз). Спины электронов складываются как вектора, сумма спинов данного числа электронов на подуровне должна быть максимальной (мультиплетность):

Заполнение электронами уровней, подуровней и орбиталей атомов элементов от Н (Z = 1) до Kr (Z = 36) показано на энергетической диаграмме (номера отвечают последовательности заполнения и совпадают с порядковыми номерами элементов):

Из заполненных энергетических диаграмм выводятся электронные формулы атомов элементов. Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы (например, 3d 5 – это 5 электронов на Зd -подуровне); вначале идут электроны 1-го уровня, затем 2-го, 3-го и т. д. Формулы могут быть полными и краткими, последние содержат в скобках символ соответствующего благородного газа, чем передается его формула, и, сверх того, начиная с Zn, заполненный внутренний d-подуровень. Примеры:
3 Li = 1s 2 2s 1 = [ 2 He]2s 1
8 O = 1s 2 2s 2 2p 4 = [ 2 He]2s 2 2p 4
13 Al = 1s 2 2s 2 2p 6 3s 2 3p 1 = [ 10 Ne]3s 2 3p 1
17 Cl = 1s 2 2s 2 2p 6 3s 2 3p 5 = [ 10 Ne]3s 2 3p 5
2O Са = 1s 2 2s 2 2p 6 3s 2 3p4s 2 = [ 18 Ar]4s 2
21 Sc = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 1 4s 2 = [ 18 Ar]3d 1 4s 2
25 Mn = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 = [ 18 Ar]3d 5 4s 2
26 Fe = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 = [ 18 Ar]3d 6 4s 2
3O Zn = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 = [ 18 Ar, 3d 10 ]4s 2
33 As = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 3 = [ 18 Ar, 3d 10 ]4s 2 4p 3
36 Kr = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 = [ 18 Ar, 3d 10 ]4s 2 4p 6
Электроны, вынесенные за скобки, называются валентными. Именно они принимают участие в образовании химических связей.
Исключение составляют:
24 Cr = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 = [ 18 Аr]Зd 5 4s 1 (а не 3d 4 4s 2 !),
29 Cu = 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 = [ 18 Ar]3d 10 4s 1 (а не 3d 9 4s 2 !).
Примеры заданий части А1. Название, не относящееся к изотопам водорода, – это
1) дейтерий
2) оксоний
2. Формула валентных подуровней атома металла – это
3. Число неспаренных электронов в основном состоянии атома железа равно
4. В возбужденном состоянии атома алюминия число неспаренных электронов равно
5. Электронная формула 3d 9 4s 0 отвечает катиону
6. Электронная формула аниона Э 2- 3s 2 3p 6 отвечает элементу
7. Суммарное число электронов в катионе Mg 2+ и анионе F - равно
Спаренные электроны
Если на орбитали находится один электрон, то он называется неспаренным, а если два – то это спаренные электроны .
Четыре квантовых числа n, l, m, m s полностью характеризуют энергетическое состояние электрона в атоме.
Рассматривая строение электронной оболочки многоэлектронных атомов различных элементов, необходимо учитывать три основных положения:
· принцип Паули,
· принцип наименьшей энергии,
· правило Гунда .
Согласно принципу Паули в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Принцип Паули определяет максимальное число электронов на одной орбитали, уровне и подуровне. Так как АО характеризуется тремя квантовыми числами n , l , m , то электроны данной орбитали могут различаться только спиновым квантовым числом m s . Но спиновое квантовое число m s может иметь только два значения + 1 / 2 и – 1 / 2 . Следовательно, на одной орбитали может находиться не более двух электронов с различными значениями спиновых квантовых чисел.
Рис. 4.6. Максимальная емкость одной орбитали – 2 электрона.
Максимальное число электронов на энергетическом уровне определяется как 2n 2 , а на подуровне – как 2(2l + 1). Максимальное число электронов, размещающихся на различных уровнях и подуровнях, приведено в табл. 4.1.
Таблица 4.1.
Максимальное число электронов на квантовых уровнях и подуровнях
| Энергети-ческий уровень | Энергети-ческий подуровень | Возможные значения магнитного квантового числа m | Число орбиталей на | Максимальное число электронов на | ||
| подуровне | уровне | подуровне | уровне | |||
| K (n =1) | s (l =0) | |||||
| L (n =2) | s (l =0) p (l =1) | –1, 0, 1 | ||||
| M (n =3) | s (l =0) p (l =1) d (l =2) | –1, 0, 1 –2, –1, 0, 1, 2 | ||||
| N (n =4) | s (l =0) p (l =1) d (l =2) f (l =3) | –1, 0, 1 –2, –1, 0, 1, 2 –3, –2, –1, 0, 1, 2, 3 |
Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом наименьшей энергии .
Согласно прнципу наименьшей энергии электроны заполняют орбитали в порядке повышения их энергии.
Очередность заполнения орбиталей определяется правилом Клечковского: увеличение энергии и, соответственно, заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равной сумме (n + l) – в порядке возрастания главного квантового числа n.
Например, энергия электрона на подуровне 4s меньше, чем на подуровне 3d , так как в первом случае сумма n + l = 4 + 0 = 4 (напомним, что для s -подуровня значение орбитального квантового числа l = = 0), а во втором n + l = 3 + 2= 5 (d - подуровень, l = 2). Поэтому, сначала заполняется подуровень 4s , а затем 3d (см. рис. 4.8).
На подуровнях 3d (n = 3, l = 2) , 4р (n = 4, l = 1) и 5s (n = 5, l = 0) сумма значений п и l одинаковы и равны 5. В случае равенства значений сумм n и l сначала заполняется подуровень с минимальным значением n , т.е. подуровень 3d .
В соответствии с правилом Клечковского энергии атомных орбиталей возрастает в ряду:
1s < 2s < 2р < 3s < 3р < 4s < 3d < 4р < 5s < 4d < 5p < 6s < 5d »
»4f < 6p < 7s ….
В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f-элементы.
 4f
4f
4 4d
3 4s
3p
3s
1 2s
Уровни Подуровни
Рис. 4.8. Энергия атомных орбиталей.
Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называются s-элементами . У s -эле-ментов валентными являются s-электроны внешнего энергетического уровня.
У р-элементов последним заполняется р-подуровень внешнего уровня. У них валентные электроны расположены на p - и s -под-уровнях внешнего уровня. У d -элементов в последнюю очередь заполняется d -подуровень предвнешнего уровня и валентными являются s -электроны внешнего и d -электроны предвнешнего энергетического уровней.
У f-элементов последним заполняется f -подуровень третьего снаружи энергетического уровня.
Порядок размещения электронов в пределах одного подуровня определяется правилом Гунда:
в пределах подуровня электроны размещаются таким образом, чтобы сумма их спиновых квантовых чисел имела бы максимальное значение по абсолютной величине.
Иными словами, орбитали данного подуровня заполняются сначала по одному электрону с одинаковым значением спинового квантового числа, а затем по второму электрону с противоположным значением.
Например, если в трех квантовых ячейках необходимо распределить 3 электрона, то каждый из них будет располагаться в отдельной ячейке, т.е. занимать отдельную орбиталь:
∑m s = ½ – ½ + ½ = ½.
Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией, или электронной формулой. Составляя электронную конфигурацию номер энергетического уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…, подуровень (орбитальное квантовое число) – буквами s , p , d , f . Число электронов на подуровне обозначается цифрой, которая записывается вверху у символа подуровня.
Электронная конфигурация атома может быть изображена в виде так называемой электронно-графической формулы . Эта схема размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с различными значениями спиновых квантовых чисел.
Чтобы составить электронную или электронно-графическую формулу любого элемента следует знать:
1. Порядковый номер элемента, т.е. заряд его ядра и соответствующее ему число электронов в атоме.
2. Номер периода, определяющий число энергетических уровней атома.
3. Квантовые числа и связь между ними.
Так, например, атом водорода с порядковым номером 1 имеет 1 электрон. Водород - элемент первого периода, поэтому единственный электрон занимает находящуюся на первом энергетическом уровне s -орбиталь, имеющую наименьшую энергию. Электронная формула атома водорода будет иметь вид:
1 Н 1s 1 .
Электронно-графическая формула водорода будет иметь вид:
Электронная и электронно-графическая формулы атома гелия:
2 Не 1s 2
2 Не 1s
отражают завершенность электронной оболочки, что обусловливает ее устойчивость. Гелий – благородный газ, характеризующийся высокой химической устойчивостью (инертностью).
Атом лития 3 Li имеет 3 электрона, это элемент II периода, значит, электроны расположены на 2-х энергетических уровнях. Два электрона заполняют s - подуровень первого энергетического уровня и 3-й электрон расположен на s - подуровне второго энергетического уровня:
3 Li 1s 2 2s 1
Валентность I
У атома лития электрон, находящийся на 2 s -подуровне, менее прочно связан с ядром, чем электроны первого энергетического уровня, поэтому в химических реакциях атом лития может легко отдавать этот электрон, превращаясь в ион Li + (ион - электрически заряженная частица ). В этом случае ион лития приобретает устойчивую завершенную оболочку благородного газа гелия:
3 Li + 1s 2 .
Следует заметить, что, число неспаренных (одиночных) электронов определяет валентность элемента, т.е. его способность образовывать химические связи с другими элементами.
Так, атом лития имеет один неспаренный электрон, что обусловливает его валентность, равную единице.
Электронная формула атома бериллия:
4 Bе 1s 2 2s 2 .
Электронно-графическая формула атома бериллия:
2 Валентность в основном
Состоянии равна 0
Легче других у бериллия отрываются электроны подуровня 2s 2 , образуя ион Be +2:
Можно заметить, что атом гелия и ионы лития 3 Li + и бериллия 4 Bе +2 имеют одинаковое электронное строение, т.е. характеризуются изоэлектронным строением.