С 2s 2 2p 2 С +1е = С -
О 2s 2 2p 4 О -1е = О +
Возможно иное объяснение образования тройной связи в молекуле СО.
Невозбужденный атом углерода имеет 2 неспаренных электрона, которые могут образовать 2 общие электронные пары с 2-мя неспаренными электронами атома кислорода (по обменному механизму). Однако имеющиеся в атоме кислорода 2 спаренные р -электрона могут образовывать тройную химическую связь, поскольку в атоме углерода имеется одна незаполненная ячейка, которая может принять эту пару электронов.
Тройная связь образуется по донорно-акцепторному механизму, направление стрелки от донора кислорода к акцептору – углероду.
Подобно N 2 - СО обладает высокой энергией диссоциации (1069 кДж), плохо растворим в воде, инертен в химическом отношении. СО – газ без цвета и запаха, безразличный несолеобразующий, не взаимодействует с кислотными щелочами и водой при обычных условиях. Ядовит, т.к. взаимодействует с железом, входящим в состав гемоглобина. При повышении температуры или облучении проявляет свойства восстановителя.
Получение:
в промышленности
CO 2 + C « 2CO
2C + O 2 ® 2CO
в лаборатории: H 2 SO 4, t
HCOOH ® CO + H 2 O;
H 2 SO 4 t
H 2 C 2 O 4 ® CO + CO 2 + H 2 O.
В реакции СО вступает лишь при высоких температурах.
Молекула СО имеет большое сродство к кислороду, горит образуя СО 2:
СО + 1/2О 2 = СО 2 + 282 кДж/моль.
Из-за большого сродства к кислороду СО используется как восстановитель оксидов многих тяжелых металлов (Fe, Co, Pb и др.).
СO + Cl 2 = COCl 2 (фосген)
CO + NH 3 ® HCN + H 2 O H – C º N
CO + H 2 O « CO 2 + H 2
CO + S ® COS
Наибольший интерес представляют карбонилы металлов (используются для получения чистых металлов). Химическая связь по донорно-акцепторному механизму, имеет место p-перекрывание по дативному механихму.
5CO + Fe ® (пентакарбонил железа)
Все карбонилы – диамагнитные вещества, характеризуются невысокой прочностью, при нагревании карбонилы разлагаются
→ 4CO + Ni (карбонил никеля).
Как и СО карбонилы металлов – токсичны.
Химическая связь в молекуле СО 2
В молекуле СО 2 sp- гибридизация атома углерода. Две sp-гибридные орбитали образуют 2 s-связи с атомами кислорода, а оставшиеся негибридизованными р-орбитали углерода дают с двумя р-орбиталями атомов кислорода p-связи, которые располагаются в плоскостях перпендикулярных друг другу.
О ═ С ═ О
Под давлением 60 атм. и комнатной температуре СО 2 сгущается в бесцветную жидкость. При сильном охлаждении жидкая СО 2 застывает в белую снегоподобную массу, возгоняющуюся при Р = 1 атм и t = 195К(-78°). Спрессованная твердая масса называется сухим льдом, СО 2 не поддерживает горения. В нем горят лишь вещества, у которых сродство к кислороду выше чем у углерода: например,
2Mg + CO 2 ® 2MgO + C.
СО 2 реагирует с NH 3:
CO 2 + 2NH 3 = CO(NH 2) 2 + H 2 O
(карбамид, мочевина)
2СО 2 + 2Na 2 O 2 ® 2Na 2 CO 3 +O 2
Мочевина разлагается водой:
CO(NH 2) 2 + 2H 2 O ® (NH 4) 2 CO 3 → 2NH 3 + СО 2
Целлюлоза – углевод, который состоит из остатков b-глюкозы. Она синтезируется в растениях по следующей схеме
хлорофилл
6CO 2 + 6H 2 O ® C 6 H 12 O 6 + 6O 2 фотосинтез глюкозы
СО 2 получают в технике:
![]()
2NaHCO 3 ® Na 2 CO 3 + H 2 O + CO 2
из кокса C + O 2 ® CO 2
В лаборатории (в аппарате Киппа):
. 
Угольная кислота и ее соли
Растворяясь в воде, углекислый газ частично взаимодействует с ней, образуя угольную кислоту H 2 CO 3 ; при этом устанавливаются равновесия:
К 1 = 4×10 -7 К 2 = 4,8×10 -11 – слабая, неустойчивая, кислородсодержащая, двухосновная кислота. Гидрокарбонаты растворимы в Н 2 О. Карбонаты нерастворимы в воде, кроме карбонатов щелочных металлов, Li 2 CO 3 и (NH 4) 2 CO 3 . Кислые соли угольной кислоты получают, пропуская избыток СО 2 в водный раствор карбоната:
либо постепенным (по каплям) добавлением сильной кислоты в избыток водного раствора карбоната:
Na 2 CO 3 + HNO 3 ® NaHCO 3 + NaNO 3
При взаимодействии со щелочами или нагревании (прокаливании) кислые соли переходят в средние:
Соли гидролизуются по уравнению:
I ступень
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Gr 3+ , Al 3+ , Ti 4+ , Zr 4+ и др.
Практическое значение имеют соли - Na 2 CO 3 (сода), CaCO 3 (мел, мрамор, известняк), K 2 CO 3 (поташ), NaHCO 3 (питьевая сода), Са(НСО 3) 2 и Mg(HCO 3) 2 обусловливают карбонатную жесткость воды.
Сероуглерод (CS 2)
При нагревании (750-1000°С) углерод реагирует с серой, образуясероуглерод, органический растворитель (бесцветная летучая жидкость, реакционноспособное вещество), огнеопасен и летуч.
![]()
Пары CS 2 – ядовиты, применяется для фумигации (окуривания) зернохранилищ против насекомых - вредителей, в ветеринарии служит для лечения аскаридоза лошадей. В технике – растворитель смол, жиров, йода.
С сульфидами металлов CS 2 образует соли тиоугольной кислоты – тиокарбонаты.
Эта реакция аналогична процессу
Тиокарбонаты – желтые кристаллические вещества. При действии на них кислот выделяется свободная тиоугольная кислота.
Она более стабильна чем Н 2 СО 3 и при низкой температуре выделяется из раствора в виде желтой маслянистой жидкости, легко разлагающейся на:
Соединения углерода с азотом (СN) 2 или С 2 N 2 – дициан, легко воспламеняющийся бесцветный газ. Чистый сухой дициан получают путем нагревания сулемы с цианидом ртути (II).
HgCl 2 + Hg(CN) 2 ® Hg 2 Cl 2 + (С N) 2
Другие способы получения:
4HCN г + О 2 2(CN) 2 +2H 2 O
2HCN г + Сl 2 (CN) 2 + 2HCl
![]()
Дициан по свойствам похож на галогены в молекулярной форме X 2 . Так в щелочной среде он, подобно галогенам, диспропорционирует:
(С N) 2 + 2NaOH = NaCN + NaOCN
Циановодород - НСN (), ковалентное соединение, газ, растворяющийся в воде с образованием синильной кислоты (бесцветная жидкость и ее соли чрезвычайно ядовиты). Получают:
![]()
Циановодород получают в промышленности по каталитическим реакциям.
2CH 4 + 3O 2 + 2NH 3 ® 2HCN + 6H 2 O.
Соли синильной кислоты – цианиды, подвержены сильному гидролизу. CN - - ион изоэлектронный молекуле СО, входит как лиганд в большое число комплексов d-элементов.
Обращение с цианидами требует строгого соблюдения мер предосторожности. В сельском хозяйстве применяют для борьбы с особо опасными насекомыми – вредителями.
Цианиды получают:
Соединения углерода с отрицательной степенью окисления :
1) ковалентные (SiC карборунд) ![]() ;
;
2) ионноковалентные;
3) металлические карбиды.
Ионноковалентные разлагаются водой с выделением газа, в зависимости от того какой выделяется газ, их делят на:
метаниды (выделяется СН 4)
Al 4 C 3 + 12H 2 O ® 4Al(OH) 3 + 3CH 4
ацетилениды (выделяется С 2 Н 2)
H 2 C 2 + AgNO 3 ® Ag 2 C 2 + HNO 3
Металлические карбиды – соединения стехиометрического состава образованные элементами 4, 7, 8 групп посредством внедрения атомов Ме в кристаллическую решетку углерода.
Химия кремния
Отличие химии кремния от углерода обусловлено большими размерами его атома и возможностью использования 3d-орбиталей. Из-за этого связи Si – O - Si, Si - F более прочны, чем у углерода.
Для кремния известны оксиды состава SiO и SiO 2 .Монооксид кремния существует только в газовой фазе при высоких температурах в инертной атмосфере; он легко окисляется кислородом с образованием более стабильного оксида SiO 2 .
2SiO + О 2 t ® 2SiO 2
SiO 2 – кремнезем, имеет несколько кристаллических модификаций. Низкотемпературная – кварц, обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидности кремнезема – халцедон, опал, агат, песок.
Известно большое разнообразие силикатов (точнее оксосиликатов). В строении их общая закономерность: все состоят из тетраэдров SiO 4 4- которые через атом кислорода соединены друг с другом.
Сочетания тетраэдров могут соединяться в цепочки, ленты, сетки и каркасы.
Важные природные силикаты 3MgO×H 2 O×4SiO 2 тальк, 3MgO×2H 2 O×2SiO 2 асбест.
Как и для SiO 2 для силикатов характерно (аморфное) стеклообразное состояние. При управляемой кристаллизации можно получить мелкокристаллическое состояние – ситаллы – материалы повышенной прочности. В природе распространены алюмосиликаты – каркасные ортосиликаты, часть атомов Si заменены на Al, например Na 12 [(Si,Al)O 4 ] 12 .
Наиболее прочный галогенид SiF 4 разлагается только под действием электрического разряда.
Гексафторокремниевая кислота (по силе близка к H 2 SO 4).
(SiS 2) n – полимерное вещество, разлагается водой:
Кремниевые кислоты.
Соответствующие SiO 2 кремниевые кислоты не имеют определенного состава, обычно их записывают в виде xH 2 O ySiO 2 – полимерные соединения
Известны:
H 2 SiO 3 (H 2 O×SiO 2) – метакремниевая (не существует реально)
H 4 SiO 4 (2H 2 O×SiO 2) – ортокремниевая (простейшая реально существующая только в растворе)
H 2 Si 2 O 5 (H 2 O×2SiO 2) – диметакремниевая.
Кремниевые кислоты – плохо растворимые вещества, для H 4 SiO 4 характерно коллоидное состояние, как кислота слабее угольной (Si менее металличен, чем С).
В водных растворах идет конденсация ортокремневой кислоты, в результате образуются поликремниевые кислоты.

Силикаты – соли кремневых кислот, в воде нерастворимы, кроме силикатов щелочных металлов.
Растворимые силикаты гидролизуются по уравнению
Желеобразные растворы натриевых солей поликремневых кислот называются «жидким стеклом». Широко применяются как силикатный клей и в качестве консерванта древесины.
Сплавлением Na 2 CO 3 , CaCO 3 и SiO 2 получают стекло, которое является переохлажденным взаимным раствором солей поликремниевых кислот.
6SiO 2 + Na 2 CO 3 + CaCO 3 ® Na 2 O × CaO × 6SiO 2 + 2CO 2 Силикат записан как смешанный оксид.
Силикаты больше всего используются в строительстве. 1 место в мире по выпуску силикатной продукции – цемент, 2-е – кирпич, 3 – стекло.
Строительная керамика – облицовочная плитка, керамические трубы. Для изготовления санитарно-технических изделий – стекло, фарфор, фаянс, глиняная керамика.
Мельчайшей частицей вещества является молекула, образующаяся в результате взаимодействия атомов, между которыми действуют химические связи или химическая связь. Учение о химической связи составляет основу теоретической химии. Химическая связь возникает при взаимодействии двух (иногда более) атомов. Образование связи происходит с выделением энергии.
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, кристаллы.
Химическая связь по своей природе едина: она имеет электростатическое происхождение. Но в разнообразных химических соединениях химическая связь бывает различного типа; наиболее важные типы химической связи – это ковалентная (неполярная, полярная), ионная, металлическая. Разновидностями этих типов связи являются донорно-акцепторная, водородная и др. Между атомами металлов возникает металлическая связь.
Химическая связь, осуществляемая за счет образования общей, или поделенной, пары или нескольких пар электронов, называется ковалентной. В образование одной общей пары электронов каждый атом вносит по одному электрону, т.е. участвует «в равной доле» (Льюис, 1916 г.). Ниже приведены схемы образования химических связей в молекулах H2, F2, NH3 и CH4. Электроны, принадлежащие различным атомам, обозначены различными символами.
В результате образования химических связей каждый из атомов в молекуле имеет устойчивую двух- и восьмиэлектронную конфигурацию.
При возникновении ковалентной связи происходит перекрывание электронных облаков атомов с образованием молекулярного электронного облака, сопровождающееся выигрышем энергии. Молекулярное электронное облако располагается между центрами обоих ядер и обладает повышенной электронной плотностью по сравнению с плотностью атомного электронного облака.

Осуществление ковалентной связи возможно лишь в случае антипараллельных спинов неспаренных электронов, принадлежащих различным атомам. При параллельных спинах электронов атомы не притягиваются, а отталкиваются: ковалентная связь не осуществляется. Метод описания химической связи, образование которой связано с общей электронной парой, называется методом валентных связей (МВС).
Основные положения МВС
Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
При написании структурных формул электронные пары, обусловливающие связь, часто изображаются черточками (вместо точек, изображающих обобществленные электроны).
Важное значение имеет энергетическая характеристика химической связи. При образовании химической связи общая энергия системы (молекулы) меньше энергии составных частей (атомов), т.е. ЕAB<ЕА+ЕB.
Валентность – это свойство атома химического элемента присоединять или замещать определенное число атомов другого элемента. С этой точки зрения валентность атома проще всего определять по числу атомов водорода, образующих с ним химические связи, или числом атомов водорода, замещаемых атомом этого элемента.
С развитием квантовомеханических представлений об атоме валентность стали определять числом неспаренных электронов, участвующих в образовании химических связей. Кроме неспаренных электронов, валентность атома также зависит от числа пустых и полностью заполненных орбиталей валентного электронного слоя.
Энергия связи – это энергия, которая выделяется при образовании молекулы из атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это одна из важнейших характеристик химической связи. Более устойчива та система, которая содержит меньше энергии. Известно, например, что атомы водорода стремятся объединиться в молекулу. Это означает, что система, состоящая из молекул Н2 содержит меньше энергии, чем система, состоящая из такого же числа атомов Н, но не объединенных в молекулы.

Рис. 2.1 Зависимость потенциальной энергии Е системы из двух атомов водорода от межъядерного расстояния r: 1 - при образовании химической связи; 2 – без ее образования.
На рисунке 2.1 показана энергетическая кривая, характерная для взаимодействующих атомов водорода. Сближение атомов сопровождается выделением энергии, которое будет тем больше, чем больше перекроются электронные облака. Однако в обычных условиях, вследствие кулоновского отталкивания, невозможно достичь слияния ядер двух атомов. Значит, на каком-то расстоянии вместо притяжения атомов, будет происходить их отталкивание. Таким образом, расстояние между атомами r0, которому отвечает минимум на энергетической кривой, будет соответствовать длине химической связи (кривая 1). Если же спины электронов у взаимодействующих атомов водорода одинаковы, то будет происходить их отталкивание (кривая 2). Энергия связи для различных атомов изменяется в пределах 170–420 кДж/моль (40–100 ккал/моль).
Процесс перехода электрона на более высокий энергетический подуровень или уровень (т.е. процесс возбуждения или распаривания, о котором говорилось ранее) требует затраты энергии. При образовании химической связи происходит выделение энергии. Для того, чтобы химическая связь была устойчивой, необходимо, чтобы увеличение энергии атома за счет возбуждения было меньше энергии образующейся химической связи. Иными словами, необходимо, чтобы затраты энергии на возбуждение атомов были скомпенсированы выделением энергии за счет образования связи.
Химическая связь, кроме энергии связи, характеризуется длиной, кратностью и полярностью. Для молекулы, состоящей более чем из двух атомов, существенными являются величины углов между связями и полярность молекулы в целом.
Кратность связи определяется количеством электронных пар, связывающих два атома. Так, в этане Н3С–СН3 связь между атомами углерода одинарная, в этилене Н2С=СН2 – двойная, в ацетилене НСºСН – тройная. С увеличением кратности связи увеличивается энергия связи: энергия связи С–С составляет 339 кДж/моль, С=С - 611 кДж/моль и CºC - 833 кДж/моль.
Химическая связь между атомами обусловливается перекрыванием электронных облаков. Если перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется сигма-связью (σ-связь). Она может быть образована за счет двух s-электронов, s- и p-электронов, двух px-электронов, s и d электронов (например
):
Химическая связь, осуществляемая одной электронной парой, называется одинарной. Одинарная связь – всегда σ-связь. Орбитали типа s могут образовывать только σ-связи.
Связь двух атомов может осуществляться более чем одной парой электронов. Такая связь называется кратной. Примером образования кратной связи может служить молекула азота. В молекуле азота px-орбитали образуют одну σ-связь. При образовании связи pz-орбиталями возникают две области
 перекрывания – выше и ниже оси х:
перекрывания – выше и ниже оси х:
Такая связь называется пи-связью (π-связь). Возникновение π-связи между двумя атомами происходит только тогда, когда они уже связаны σ-связью. Вторую π-связь в молекуле азота образуют ру-орбитали атомов. При образовании π-связей электронные облака перекрываются меньше, чем в случае σ-связей. Вследствие этого π-связи, как правило, менее прочны, чем σ-связи, образованные теми же атомными орбиталями.
р-орбитали могут образовывать как σ-, так и π-связи; в кратных связях одна из них обязательно является σ-связью:
.Таким образом, в молекуле азота из трех связей одна - σ-связь и две - π-связи.
Длиной связи называется расстояние между ядрами связанных атомов. Длины связей в различных соединениях имеют величины десятых долей нанометра. При увеличении кратности длины связей уменьшаются: длины связей N–N , N=N и NºN равны 0,145; 0,125 и 0,109 нм (10-9 м), а длины связей C-C, C=C и CºC равны, соответственно, 0,154; 0,134 и 0,120 нм.
Между разными атомами чистая ковалентная связь может проявляться, если электроотрицаельность (ЭО) акие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому их называют неполярными.

Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с большей ЭО:

Смещение электронного облака называется поляризацией. В результате односторонней поляризации центры тяжести положительных и отрицательных зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое расстояние (l). Такие молекулы называются полярными или диполями, а связь между атомами в них называется полярной.
Полярная связь – разновидность ковалентной связи, претерпевшей незначительную одностороннюю поляризацию. Расстояние между «центрами тяжести» положительных и отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше поляризация, тем больше длина диполя и больше полярность молекул. Для оценки полярности молекул обычно пользуются постоянным дипольным моментом (Мр), представляющим собой произведение величины элементарного электрического заряда (e) на длину диполя (l), т.е.
.Природа химической связи. Квантово-механическая трактовка механизма образования химической связи.
Типы связей: ковалентная, ионная, координационная (донорно-акцепторная), металлическая, водородная.
Характеристики связи: энергия и длина связи, направленность, насыщенность, электрические дипольные моменты, эффективные заряды атомов, степень ионности.
Метод валентных связей (ВС). Сигма- и пи-связи. Типы гибридизации атомных орбиталей и геометрия молекул. Неподеленные электронные пары молекул.
Метод молекулярных орбиталей (МО) и особенности использованной в нем волновой функции. Связывающие и разрыхляющие молекулярные орбитали. Принципы заполнения их электронами, порядок и энергия связей. Связи в двухатомных гомоядерных молекулах.
Свойства химических связей в твердом состоянии вещества. Свойства ионных кристаллов. Металлическая связь и строение металлических кристаллов. Специфические свойства металлов. Молекулярные кристаллы и их свойства.
Применение теории химической связи в химии и биологии. Энергия ковалентных связей и энергетика химических реакций. Предсказание геометрии молекул. Гибкость биомолекул как результат свободного вращения вокруг s-связей. Взаимодействие биомолекул с водой как следствие образования водородных связей и взаимодействия диполей воды с атомами, имеющими значительные заряды.
Вариант 1
1. Какую связь называют ионной? Покажите механизм возникновения ионной связи на примере образования фторида калия. Можно ли говорить о молекуле CI для твердого состояния вещества?
2. В каких молекулах из перечисленных ниже имеется p-связь? CH 4 ; N 2 ; BeCl 2 ; CO 2 . Ответ подтвердите графическими формулами.
3. Каков механизм переменной валентности элементов? Почему сера проявляет переменную валентность, кислород всегда не более чем двухвалентен?
4. Обозначьте тип гибридизации орбиталей в молекулах CH 4 , MgCl 2 , BF 3 .
Вариант 2
1. В чем заключается особенность типично ковалентной связи? Покажите механизм возникновения этой связи в обобщенно-схематическом виде.
2. Из числа перечисленных ниже соединений выпишите двумя столбцами молекулы с одинарной и кратной связью. Те, в которых имеются π-связь, подчеркните.
C 2 H 4 , NH 3 , N 2 , CCl 4 , SO 2 , H 2 O.
3. Как влияет характер химической связи атомов на свойства веществ (способность к диссоциации, t и т. д.)?
4. Изобразите рисунком процесс Sp 2 -гибридизации. Приведите пример соответствующей молекулы и укажите ее геометрию.
Вариант 3
1. Как изменяется запас энергии молекул по сравнению с запасом энергии разрозненных атомов? Какая молекула прочнее: H 2 (E CB = 431,8 кДж) или N 2 (E CB = 945 кДж)?
2. Чем определяется величина ковалентности элемента? Приведите графические формулы молекул N 2 , NH 3 , NO и определите в каждой из них ковалентность азота.
3. Что называют гибридизацией орбиталей? Нарисуйте одну гибридную орбиталь и объясните, почему гибридные связи образуют более прочную связь, чем негибридные.
4. Дайте общую характеристику кристаллических веществ и назовите типы кристаллических решеток.
Вариант 4
1. Перечислите основные виды химических связей и приведите по одному примеру соответствующих этим видам связи химических соединений.
2. Изобразите рисунками два возможных способа перекрывания р-электронных облаков.
3. Что называют длиной диполя и дипольным моментом молекулы? От чего зависит величина дипольного момента?
4. Из перечисленных ниже молекул выпишите те, в которых имеются Sp-гибридные орбитали, и укажите их геометрию.
BeCl 2 , BCl 3 , H 2 O, C 2 H 2 .
Вариант 5
1. В чем особенность донорно-акцепторной связи? Покажите ее механизм в обобщенно-схематической форме и на примере.
2. От чего зависит величина ковалентности атома в молекуле? Имеет ли ковалентность знак? Определите ковалентность серы в молекуле H 2 S и ионе по их графическим формулам.
3. Сколько σ- и π-связей в молекуле N+, ионе ?
4. Почему молекула CaCl 2 (в парах) имеет линейную форму, молекула BCl 3 треугольную – плоскую, а молекула CCl 4 – тетраэдрическую?
Вариант 6
1. Какова физическая природа типично ковалентной связи в соответствии с представлениями волновой механики? Какими должны быть спины электронов взаимодействующих атомов, чтобы они могли вступить друг с другом в химическое взаимодействие?
2. Как современная теория химической связи объясняет переменную валентность элементов? Приведите пример.
3. Объясните с помощью графических формул? почему при наличии полярных связей в молекулах CO 2 и SO 2 одна из них неполярна, а другая полярна.
4. Выпишите химические соединения, в образовании которых участвуют Sp 2 -гибридные орбитали C 2 H 4 ; CH 4 ; BCl 3 ; C 2 H 2 .
Вариант 7
1. В каких случаях и как возникает водородная связь? Приведите примеры.
2. Выпишите те из приведенных ниже молекул, в которых имеется типично-ковалентная связь между атомами PCl 3 ; N 2 ; K 2 S; SO 3 . Приведите их графические формулы.
3. Каким принципам и правилам подчиняется заполнение и атомных, и молекулярных орбиталей? Как определяется число химических связей в молекуле по методу МО?
4. Какие из перечисленных молекул имеют угловую форму? CO 2 , SO 2 , H 2 O.
Вариант 8
1. В чем заключаются особенности металлической связи?
2. Сколько холостых электронов у атомов Al и Sе в основном состоянии? Какой процесс обусловливает возможность повышения ковалентности этих элементов до величины, соответствующей номеру их группы в системе Д. И. Менделеева?
3. В каких из приведенных молекул абсолютное значение, степени окисления и ковалентность подчеркнутых элементов не совпадают?
N 2 , H 2 , NH 3 , C 2 H 2 .
Ответ обоснуйте графическими формулами.
4. Изобразите схематически процесс Sp 3 -гибридизации орбиталей. Приведите примермолекулы, в которой осуществляется этот тип гибридизации.
Вариант 9
1. Для каких из перечисленных ниже молекул возможны межмолекулярные водородные связи и почему? СаН 2 , Н 2 О, HF 2 , CH 4 .
2. От чего зависит степень поляризации связи между атомами в молекуле и что является ее количественной характеристикой?
3. Сколько σ- и π-связей в молекуле СО 2 ? Какой здесь тип гибридизации орбиталей атома углерода?
4. Какие из перечисленных веществ имеют в твердом состоянии молекулярные, а какие – ионные кристаллические решетки?
NaJ, H 2 O, K 2 SO 4 , CO 2 , J 2 .
Вариант 10
1. Изобразите по методу валентных схем (ВС) строение молекул Н 2 , N 2 и NH 3 . Каков тип связи между атомами этих молекул? В какой из молекул имеются π-связи?
2. По типу химической связи определите, у какого из перечисленных ниже веществ а) наибольшая способность к диссоциации; б) самая низкая температура плавления; в) самая высокая температура кипения. HF; Cl 2 .
3. В чем заключается направленность ковалентной связи? Покажите на примере строения молекулы воды, как влияет направленность связи на геометрию молекулы.
4. В каких из перечисленных молекул углы связи между атомами равны 180°?. Какой тип гибридизации орбиталей это объясняет?
CH 4 , BF 3 , MgCl 2 , C 2 H 2 .
Вариант 11
1. Какие электроны: спаренные или холостые – определяют возможное число типично-ковалентных связей атома в данном энергетическом состоянии? В качестве примера рассмотрите атом серы.
2. Чем отличаются друг от друга σ- и π-связи? Могут ли гибридные орбитали образовывать π-связь? Сравните прочность π- и σ-связей.
3. Изобразите рисунком схему Sр-гибридизации орбиталей и выпишите те из приведенных молекул, в которых имеется этот тип гибридизации.
BeCl 2 , CH 4 , AlF 3 , C 2 H 2 .
4. Дайте общую характеристику особенностей аморфных тел.
Вариант 12
1. Чем отличаются ковалентно-неполярная и ковалентно-полярная связь? Объясните на примерах, в каких случаях они возникают.
2. Укажите типы связей в следующих соединениях и ионах:
CsF, 2+ , Cl 2 , SO 3 .
3. Сколько гибридных орбиталей образуется при Sр 3 -гибридизации? Какова геометрия молекулы СН 4 , в которой этот тип гибридизации осуществляется?
4. Какие известны типы межмолекулярных взаимодействий?
Вариант 13
1. По величинам электроотрицательности атомов серы, хлора и натрия определите, какие из них образуют друг с другом ионную, а какие – ковалентную связь.
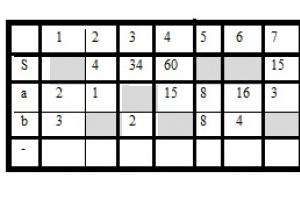
2. Перечертите таблицу и заполните ее для подчеркнутых атомов.
3. Почему фосфор может образовывать соединения PCl 3 и PCl 5 , а азот – только NCl 3 ? К какому атому смещена во всех этих молекулах электронная пара?
4. Какие из перечисленных молекул имеют форму тетраэдра и почему?
Вариант 14
1. Чем определяется величина электровалентности элемента в ионных соединениях? Обозначьте электровалентность в соединениях K 2 S, MgCl 2 , AlCl 3 . Совпадает ли она со степенью окисления?
2. Чем отличается метод молекулярных орбиталей (МО) от метода валентных связей (ВС)? Приведите схемы образования молекулы водорода по методу ВС и методу МО.
3. Какие типы связей имеются в молекуле NH 4 Cl? Покажите их на электронной схеме строения молекулы.
4. Укажите типы гибридизации орбиталей и геометрию молекул BeF 2 , СH 4 , BCl 3 .
Химическая связь.
определение химической связи;
типы химических связей;
метод валентных связей;
основные характеристики ковалентной связи;
механизмы образования ковалентной связи;
комплексные соединения;
метод молекулярных орбиталей;
межмолекулярные взаимодействия.
ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОЙ СВЯЗИ
Химической связью называют взаимодействие между атомами, приводящее к образованию молекул или ионов и прочному удерживанию атомов друг около друга.
Химическая связь имеет электронную природу, т. е. осуществляется за счёт взаимодействия валентных электронов. В зависимости от распределения валентных электронов в молекуле, различают следующие виды связей: ионная, ковалентная, металлическая и др. Ионную связь можно рассматривать как предельный случай ковалентной связи между атомами, резко отличающимися по природе.
ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ
Ионная связь.
Основные положения современной теории ионной связи.
Ионная связь образуется при взаимодействии элементов, резко отличающихся друг от друга по свойствам, т. е. между металлами и неметаллами.
Образование химической связи объясняется стремлением атомов к достижению устойчивой восьмиэлектронной внешней оболочки (s 2 p 6).
Ca: 1s 2 2s 2 p 6 3s 2 p 6 4s 2
 Ca 2+ :
1s 2 2s 2 p 6 3s
2
p
6
Ca 2+ :
1s 2 2s 2 p 6 3s
2
p
6
Cl: 1s 2 2s 2 p 6 3s 2 p 5
 Cl – :
1s 2 2s 2 p 6 3s
2
p
6
Cl – :
1s 2 2s 2 p 6 3s
2
p
6
Образовавшиеся разноименно заряженные ионы удерживаются друг около друга за счёт электростатического притяжения.
Ионная связь не направленная.
Чисто ионной связи не существует. Так как энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой разницей электроотрицательностей. Поэтому можно говорить о доле ионности связи. Наибольшая ионность связи имеет место во фторидах и хлоридах s-элементов. Так, в кристаллахRbCl,KCl,NaClиNaFона равна 99, 98, 90 и 97% соответственно.
Ковалентная связь.
Основные положения современной теории ковалентной связи.
Ковалентная связь образуется между элементами, сходными по свойствам, то есть, неметаллами.
Каждый элемент предоставляет для образования связей 1 электрон, причём спины электронов должны быть антипараллельными.
Если ковалентная связь образована атомами одного и того же элемента, то эта связь не полярная, т. е. общая электронная пара не смещена ни к одному из атомов. Если же ковалентная связь образована двумя разными атомам, то общая электронная пара смещена к наиболее электроотрицательному атому, это полярная ковалентная связь .
При образовании ковалентной связи происходит перекрывание электронных облаков взаимодействующих атомов, в результате, в пространстве между атомами возникает зона повышенной электронной плотности, притягивающая к себе положительно заряженные ядра взаимодействующих атомов, и удерживающая их друг около друга. Вследствие этого снижается энергия системы (рис. 14). Однако при очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи ,l св), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи – Е св.

Рис. 14. Зависимость энергии систем из двух атомов водорода с параллельными (1) и антипараллельными (2) спинами от расстояния между ядрами (Е – энергия системы, Е св – энергия связи,r– расстояние между ядрами,l – длина связи).
Для описания ковалентной связи используют 2 метода: метод валентных связей (ВС) и метод молекулярных орбиталей (ММО).
МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ.
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Для наглядного изображения валентных схем обычно пользуются следующим способом: электроны, находящиеся во внешнем электронном слое обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек:
N:
1s 2 2s
2
p
3
;

C: 1s 2 2s 2 p 4
Из приведенных схем видно, что каждая пара электронов, связывающая два атома, соответствует одной черточке, изображающей ковалентную связь в структурных формулах:

Число общих электронных пар, связывающих атом данного элемента с другими атомами, или, иначе говоря, число образуемых атомом ковалентных связей, называется ковалентностью по методу ВС. Так, ковалентность водорода равна 1, азота – 3.
По способу перекрывания электронных облаков, связи бывают двух видов: - связь и - связь.
- связь возникает при перекрывании двух электронных облаков по оси, соединяющей ядра атомов.
Рис. 15. Схема образования - связей.
- связь образуется при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра взаимодействующих атомов.

Рис. 16. Схема образования - связей.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ.
1. Длина связи, ℓ. Это минимальное расстояние между ядрами взаимодействующих атомов, которое соответствует наиболее устойчивому состоянию системы.
2. Энергия связи, E min – это то количество энергии, которое необходимо затратить для разрыва химической связи и для удаления атомов за пределы взаимодействия.
3. Дипольный момент связи, ,=qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
неполярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей:
,=qℓ.
Дипольный момент служит количественной
мерой полярности молекулы. Для неполярных
молекул дипольный момент равен 0, для
неполярных не равен 0. Дипольный момент
многоатомной молекулы равен векторной
сумме диполей отдельных связей:

4. Ковалентная связь характеризуется направленностью. Направленность ковалентной связи определяется необходимостью максимального перекрывания в пространстве электронных облаков взаимодействующих атомов, которые приводят к образованию наиболее прочных связей.
Так как эти -связи строго ориентированы в пространстве, в зависимости от состава молекулы они могут находиться под определенным углом друг к другу – такой угол называется валентным.
Двухатомные молекулы имеют линейное строение. Многоатомные молекулы имеют более сложную конфигурацию. Рассмотрим геометрию различных молекул на примере образования гидридов.
1. VIгруппа, главная подгруппа (кроме кислорода), Н 2 S, Н 2 Sе, Н 2 Те.
S1s 2 2s 2 р 6 3s 2 р 4
У водорода в образовании связи участвует электрон с s-АО, у серы – 3р у и 3р z . Молекула Н 2 Sимеет плоское строение с углом между связями 90 0 . .

Рис 17. Строение молекулы Н 2 Э
2. Гидриды элементов Vгруппы, главной подгруппы: РН 3 , АsН 3 ,SbН 3 .
Р 1s 2 2s 2 р 6 3s 2 р 3 .
В образовании связи принимают участие: у водорода s-АО, у фосфора - р у, р х и р z АО.
Молекула РН 3 имеет форму тригональной пирамиды (в основании – треугольник).

Рис 18. Строение молекулы ЭН 3
5. Насыщаемость ковалентной связи - это число ковалентных связей, которые может образовывать атом. Оно ограничено, т.к. элемент обладает ограниченным количеством валентных электронов. Максимальное число ковалентных связей, которые может образовывать данный атом в основном или возбуждённом состоянии, называется его ковалентностью.
Пример: водород – одноковалентен, кислород – двухковалентен, азот – трёхковалентен и т. д.
Некоторые атомы могут повышать свою ковалентность в возбуждённом состоянии за счёт разъединения спаренных электронов.
Пример. Be 0 1s 2 2s 2

У атома бериллия в возбужденном состоянии один валентный электрон находится на 2p-АО и один электрон на 2s-АО, то есть ковалентностьBe 0 = 0 а ковалентностьBe* = 2. В ходе взаимодействия происходит гибридизация орбиталей.
Гибридизация - это выравнивание энергии различных АО в результате смешения перед химическим взаимодействием. Гибридизация - условный прием, позволяющий предсказать структуру молекулы при помощи комбинации АО. В гибридизации могут принимать участие те АО, энергии которых близки.
Каждому виду гибридизации соответствует определенная геометрическая форма молекул.
В случае гидридов элементов IIгруппы главной подгруппы в образовании связи участвуют две одинаковыеsр-гибридные орбитали. Подобный тип связи называетсяsр-гибридизация.

Рис 19. Молекула ВеН 2 .sp-Гибридизация.
sp-Гибридные орбитали имеют несимметричную форму, в сторону водорода направлены удлиненные части АО с валентным углом, равным 180 о. Поэтому молекула ВеН 2 имеет линейное строение (рис.).
Строение молекул гидридов элементов IIIгруппы главной подгруппы рассмотрим на примере образования молекулыBH 3 .
B 0 1s 2 2s 2 p 1

Ковалентность B 0 = 1, ковалентностьB* = 3.
В образовании связей принимают участие три sр-гибридные орбитали, которые образуются в результате перераспределения электронных плотностейs-АО и двух р-АО. Такой тип связи называетсяsр 2 - гибридизацией. Валентный угол приsр 2 - гибридизации равен 120 0 , поэтому молекула ВН 3 имеет плоское треугольное строение.

Рис.20. Молекула BH 3 . sp 2 -Гибридизация.
На примере образования молекулы СH 4 рассмотрим строение молекул гидридов элементовIVгруппы главной подгруппы.
C 0 1s 2 2s 2 p 2

Ковалентность C 0 = 2, ковалентностьC* = 4.
У углерода в образовании химической связи участвуют четыре sр-гибридные орбитали, образованные в результате перераспределения электронных плотностей междуs-АО и тремя р-АО. Форма молекулы СН 4 - тетраэдр, валентный угол равен 109 о 28`.

Рис. 21. Молекула СН 4 .sp 3 -Гибридизация.
Исключениями из общего правила являются молекулы Н 2 О иNН 3 .
В молекуле воды углы между связями равны 104,5 о. В отличии от гидридов других элементов этой группы, вода имеет особые свойства, она полярна, диамагнитна. Все это объясняется тем, что в молекуле воды тип связиsр 3 . То есть в образовании химической связи участвуют четыреsр - гибридные орбитали. На двух орбиталях находится по одному электрону, эти орбитали взаимодействуют с водородом, на двух других орбиталях находится по паре электронов. Наличие этих двух орбиталей и объясняет уникальные свойства воды.
В молекуле аммиака углы между связями равны примерно 107,3 о, то есть форма молекулы аммиака - тетраэдр, тип связиsр 3 . В образовании связи у молекулы азота принимает участие четыре гибридныеsр 3 -орбитали. На трех орбиталях находится по одному электрону, эти орбитали связаны с водородом, на четвертой АО находится неподеленная пара электронов, которая обуславливает уникальность молекулы аммиака.
МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ.
МВС позволяет различать три механизма образования ковалентной связи: обменный, донорно-акцепторный, дативный.
Обменный механизм . К нему относят те случаи образования химической связи, когда каждый из двух связываемых атомов выделяет для обобществления по одному электрону, как бы обмениваясь ими. Для связывания ядер двух атомов нужно, чтобы электроны находились в пространстве между ядрами. Эта область в молекуле называется областью связывания (область наиболее вероятного пребывания электронной пары в молекуле). Чтобы произошел обмен не спаренными электронами у атомов необходимо перекрывание атомных орбиталей (рис. 10,11). В этом и заключается действие обменного механизма образования ковалентной химической связи. Атомные орбитали могут перекрываться только в том случае, если они обладают одинаковыми свойствами симметрии относительно межъядерной оси (рис. 10, 11, 22).

Рис. 22. Перекрывание АО, не приводящее к образованию химической связи.
Донорно-акцепторный и дативный механизмы .
Донорно-акцепторный механизм связан с передачей неподеленной пары электронов от одного атома на вакантную атомную орбиталь другого атома. Например, образование иона - :

Вакантная р-АО в атоме бора в молекуле BF 3 акцептирует пару электронов от фторид-иона (донор). В образовавшемся анионе четыре ковалентные связи В-Fравноценны по длине и энергии. В исходной молекуле все три связи В-Fобразовались по обменному механизму.
Атомы, внешняя оболочка которых состоит только из s- или р-электронов, могут быть либо донорами, либо акцепторами неподеленной пары электронов. Атомы, у которых валентные электроны находятся и наd-АО, могут одновременно выступать и в роли доноров, и в роли акцепторов. Чтобы различить эти два механизма ввели понятия дативного механизма образования связи.
Простейший пример проявления дативного механизма - взаимодействие двух атомов хлора.
Два атома хлора в молекуле хлора образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, атом Сl- 1 передает неподеленную пару электронов 3р 5 - АО атому Сl- 2 на вакантную 3d-АО, а атом Сl- 2 такую же пару электронов на вакантную 3d-АО атома Сl- 1. Каждый атом выполняет одновременно функции акцептора и донора. В этом и есть дативный механизм. Действие дативного механизма повышает прочность связи, поэтому молекула хлора прочнее молекулы фтора.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.
По принципу донорно-акцепторного механизма образуется огромный класс сложных химических соединений - комплексные соединения.
Комплексные соединения - это соединения, имеющие в своем составе сложные ионы, способные к существованию как в кристаллическом виде, так и в растворе, включающие центральный ион или атом, связанный с отрицательно заряженными ионами или нейтральными молекулами ковалентными связями, образованными по донорно-акцепторному механизму.
Структура комплексных соединений по Вернеру.
Комплексные соединения состоят из внутренней сферы (комплексный ион) и внешней сферы. Связь между ионами внутренней сферы осуществляется по донорно-акцепторному механизму. Акцепторы называются комплексообразователями, ими часто могут быть положительные ионы металлов (кроме металлов IAгруппы), имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера.
Доноры электронной пары называются лигандами или аддендами. Лигандами являются нейтральные молекулы или отрицательно заряженные ионы. Количество лигандов определяется координационным числом комплексообразователя, которое, как правило, равно удвоенной валентности иона-комплексообразователя. Лиганды бывают монодентантными и полидентантными. Дентантность лиганда определяется числом координационных мест, которые лиганд занимает в координационной сфере комплексообразователя. Например, F - - монодентантный лиганд,S 2 O 3 2- - бидентантный лиганд. Заряд внутренней сферы равен алгебраической сумме зарядов составляющих ее ионов. Если внутренняя сфера имеет отрицательный заряд – это анионный комплекс, если положительный – катионный. Катионные комплексы называют по имени иона-комплексообразователя по-русски, в анионных комплексах комплексообразователь называется по-латыни с добавлением суффикса –ат . Связь между внешней и внутренней сферами в комплексном соединении – ионная.
Пример: K 2 – тетрагидроксоцинкат калия, анионный комплекс.
2- - внутренняя сфера
2K + - внешняя сфера
Zn 2+ - комплексообразователь
OH – - лиганды
координационное число – 4
связь между внешней и внутренней сферами ионная:
K 2 = 2K + + 2- .
связь между ионом Zn 2+ и гидроксильными группами – ковалентная, образованная по донорно-акцепторному механизму:OH – - доноры,Zn 2+ - акцептор.
Zn 0: … 3d 10 4s 2
Zn 2+ : … 3d 10 4s 0 p 0 d 0

Типы комплексных соединений :
1. Аммиакаты - лиганды молекулы аммиака.
Cl 2 – хлорид тетраамминмеди (II). Аммиакаты получают действием аммиака на соединения, содержащие комплексообразователь.
2. Гидроксосоединения - лиганды ОН - .
Na – тетрагидроксоалюминат натрия. Получают гидроксокомплексы действием избытка щелочи на гидроксиды металлов, обладающие амфотерными свойствами.
3. Аквакомплексы - лиганды молекулы воды.
Cl 3 – хлорид гексааквахрома (III). Аквакомплексы получают взаимодействием безводных солей с водой.
4. Ацидокомплексы - лиганды анионы кислот – Cl - ,F - ,CN - ,SO 3 2- ,I – ,NO 2 – ,C 2 O 4 – и др.
K 4 – гексацианоферрат (II) калия. Получают взаимодействием избытка соли, содержащей лиганд на соль, содержащую комплексообразователь.
МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ.
МВС
достаточно хорошо объясняет образование
и структуру многих молекул, но этот
метод не универсален. Например, метод
валентных связей не даёт удовлетворительного
объяснения существованию иона
 ,
хотя еще в конце XIX
века было установлено существование
довольно прочного молекулярного иона
водорода
,
хотя еще в конце XIX
века было установлено существование
довольно прочного молекулярного иона
водорода
 :
энергия разрыва связи составляет здесь
2,65эВ. Однако никакой электронной пары
в этом случае образовываться не может,
поскольку в состав иона
:
энергия разрыва связи составляет здесь
2,65эВ. Однако никакой электронной пары
в этом случае образовываться не может,
поскольку в состав иона
 входит всего один электрон.
входит всего один электрон.
Метод молекулярных орбиталей (ММО) позволяет объяснить ряд противоречий, которые нельзя объяснить, используя метод валентных связей.
Основные положения ММО.
При взаимодействии двух атомных орбиталей, образуются две молекулярные орбитали. Соответственно, при взаимодействии n-атомных орбиталей, образуется n-молекулярных орбиталей.
Электроны в молекуле в равной степени принадлежат всем ядрам молекулы.
Из двух образовавшихся молекулярных орбиталей, одна обладает более низкой энергией, чем исходная, это связывающая молекулярная орбиталь , другая обладает более высокой энергией чем исходная, это разрыхляющая молекулярная орбиталь .
В ММО используют энергетические диаграммы без масштаба.
При заполнении энергетических подуровней электронами, используют те же правила, что и для атомных орбиталей:
принцип минимальной энергии, т.е. в первую очередь заполняются подуровни, обладающие меньшей энергией;
принцип Паули: на каждом энергетическом подуровне не может быть больше двух электронов с антипараллельными спинами;
правило Хунда: заполнение энергетических подуровней идёт таким образом, чтобы суммарный спин был максимальным.
Кратность связи. Кратность связи в ММО определяется по формуле:
 ,
когда К p
= 0, связь не образуется.
,
когда К p
= 0, связь не образуется.
Примеры.
1. Может ли существовать молекула Н 2 ?

Рис. 23. Схема образования молекулы водорода Н 2 .
Вывод: молекула Н 2 будет существовать, так как кратность связи Кр > 0.
2. Может ли существовать молекула Не 2 ?

Рис. 24. Схема образования молекулы гелия He 2 .
Вывод: молекула Не 2 не будет существовать, так как кратность связи Кр = 0.
3. Может ли существовать частица Н 2 + ?

Рис. 25. Схема образования частицы Н 2 + .
Частица Н 2 + может существовать, так как кратность связи Кр > 0.
4. Может ли существовать молекула О 2 ?

Рис. 26. Схема образования молекулы О 2 .
Молекула О 2 существует. Из рис.26 следует, что у молекулы кислорода имеется два неспаренных электрона. За счет этих двух электронов молекула кислорода парамагнитна.
Таким образом метод молекулярных орбиталей объясняет магнитные свойства молекул.
МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ.
Все межмолекулярные взаимодействия можно разделить на две группы: универсальные испецифические . Универсальные проявляются во всех молекулах без исключения. Эти взаимодействия часто называютсвязью или силами Ван-дер-Ваальса . Хотя эти силы слабые (энергия не превышает восемь кДж/моль), они являются причиной перехода большинства веществ из газообразного состояния в жидкое, адсорбции газов поверхностями твердых тел и других явлений. Природа этих сил электростатическая.
Основные силы взаимодействия:
1). Диполь – дипольное (ориентационное) взаимодействие существует между полярными молекулами.
Ориентационное взаимодействие тем больше, чем больше дипольные моменты, меньше расстояния между молекулами и ниже температура. Поэтому чем больше энергия этого взаимодействия, тем до большей температуры нужно нагреть вещество, чтобы оно закипело.
2). Индукционное взаимодействие осуществляется, если в веществе имеется контакт полярных и неполярных молекул. В неполярной молекуле индуцируется диполь в результате взаимодействия с полярной молекулой.
Cl + - Cl - … Al + Cl - 3
Энергия этого взаимодействия возрастает с увеличением поляризуемости молекул, то есть способности молекул к образованию диполя под воздействием электрического поля. Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия.
3). Дисперсионное взаимодействие – это взаимодействие неполярных молекул за счет мгновенных диполей, возникающих за счет флуктуации электронной плотности в атомах.
В ряду однотипных веществ дисперсионное взаимодействие возрастает с увеличением размеров атомов, составляющих молекулы этих веществ.
4) Силы отталкивания обусловлены взаимодействием электронных облаков молекул и проявляются при их дальнейшем сближении.
К специфическим межмолекулярным взаимодействиям относятся все виды взаимодействий донорно-акцепторного характера, то есть, связанные с переносом электронов от одной молекулы к другой. Образующаяся при этом межмолекулярная связь обладает всеми характерными особенностями ковалентной связи: насыщаемостью и направленностью.
Химическая связь, образованная положительно поляризованным водородом, входящим в состав полярной группы или молекулы и электроотрицательным атомом другой или той же молекулы, называется водородной связью. Например, молекулы воды можно представить следующим образом:

Сплошные черточки – ковалентные полярные связи внутри молекул воды между атомами водорода и кислорода, точками обозначены водородные связи. Причина образования водородных связей состоит в том, что атомы водорода практически лишены электронных оболочек: их единственные электроны смещены к атомам кислорода своих молекул. Это позволяет протонам, в отличие от других катионов, приближаться к ядрам атомов кислорода соседних молекул, не испытывая отталкивания со стороны электронных оболочек атомов кислорода.
Водородная связь характеризуется энергией связи от 10 до 40 кДж/моль. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, т.е. их ассоциацию в димеры или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар.
Например, фтороводород в газовой фазе существует в виде димера.

В сложных органических молекулах существуют как межмолекулярные водородные связи так и внутримолекулярные водородные связи.

Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями не образуют ассоциатов, более летучи, имеют более низкие вязкости, температуры плавления и кипения, чем их изомеры, способные образовывать межмолекулярные водородные связи.
БК Леон является ведущим онлайн-букмекером на гемблинговом рынке. Компания повышенное внимание уделяет бесперебойной работе сервиса. Также постоянно совершенствуется функционал портала. Для удобства пользователей создано зеркало Леон.
Перейти на зеркало
Что такое зеркало Леон.
Для получения доступа к официальному порталу БК Leon, необходимо воспользоваться зеркалом. Пользователю рабочее зеркало предоставляет множество преимуществ таких, как:
- разнообразная линейка спортивных мероприятий, которые имеют высокие коэффициенты;
- предоставление возможности игры в режиме Live, смотреть матчи будет интересным занятием;
- подробный материал относительно проведенных соревнований;
- удобный интерфейс, с которым быстро разберется даже неопытный пользователь.
Рабочее зеркало представляет собой копию официального портала. Он имеет идентичную функциональность и синхронную базу данных. За счет этого данные учетной записи не меняются. Разработчиками предусмотрена возможность блокировки рабочего зеркала, на такой случай предоставляется иное. Данные точные копии рассылаются и контролируются сотрудниками БК Леон. Если воспользоваться функционирующим зеркалом, то можно получить доступ к официальному порталу БК Леон.
Пользователю не составит трудностей найти зеркало, так как их список подлежит обновлению. При закрытом доступе от посетителя сайта требуется выполнить установку приложения Леон для мобильного телефона на компьютер. Также нужно поменять IP на иную страну за счет VPN. Для изменения местоположения пользователя или провайдера нужно воспользоваться TOP-браузером.
Разработчики предусмотрели различные возможности пользования зеркалом. Для этого с правой стороны сайта имеется надпись “Доступ к сайту”, зеленая кнопка “Обход блокировок” позволяет игроку зайти в подменю и добавить универсальную закладку в браузер.
Также удобство пользователю предоставляет мобильное приложение. Если необходимо узнать о новом адресе зеркала портала, можно позвонить по бесплатному телефону. Получать доступ к зеркалу позволяет канал @leonbets_official на Telegram . Приложение Leonacsess для Windows позволяет всегда получить доступ к сайту. Данные способы дают возможность получить игроку доступ к рабочему зеркалу.
Почему заблокировали основной сайт Леон
Это происходит вследствие действий службы Роскомнадзора. Это связано с отсутствием лицензии на ведение букмекерской деятельности. Синий Leon не получил лицензию, чтобы игрок не платил с выигрыша 13%.
Как зарегистрироваться на зеркале Леонбетс
Зарегистрироваться на этом сайте значительно проще, чем официально. Пользователю не требуется регистрироваться на двух порталах, что занимает до двух дней. Если отдать предпочтение рабочему зеркалу, то данная процедура будет максимально простой.
Для этого пользователю понадобится только заполнить данные относительно Ф. И. О., контакты. Также необходимо определиться с валютой, указать дату рождения и домашний адрес. Также нужно подписаться на рассылку сообщений. Это позволит оперативно получать информацию от букмекеров. Зарегистрированный пользователь получает возможность иметь доступ к личному кабинету, что позволяет произвести ставку на матчи, мероприятия. При возникновении сложностей можно обратиться в службу технической поддержки.