установлено, что атом состоит из двух областей, несущих противоположные заряды.
Заряд области, где сосредоточена почти вся масса атома, условно принято считать положительным. Эта область названа ядром атома. Область положительного заряда атома – ядро - несмотря на преобладание ее массы очень невелика по размерам.
За исключением ядра атома водорода, ядра атомов состоят из
протонов и нейтронов, называемых нуклонами. Протон р – частица имеющая массу mp = 1,6726 ·10 -27 кг и положительный электрический заряд 1,6022·10 -19 Кл . Нейтрон n – незаряженная частица, обладающая массой mn = 1,6750 ·10 -27 кг.
На некотором расстоянии от ядра располагаются области с противоположным зарядом – так называемые электронные орбитали
– области определенной вероятности нахождения электрона. Электрон – элементарная частица, обладающая наименьшей массой покоя m e = 0,91095·10-30 кг. Заряд электрона принято считать отрицательным. Электроны имеют отрицательный электрический заряд, равный 1,6022·10-19 Кл.
Общее число электронов в атоме равно числу протонов в ядре и поэтому атом электрически нейтрален.
Геометрический размер атома, условно описываемый диаметром его электронной оболочки, имеет порядок 10-10 м, а диаметр атомного ядра – 10-14 м, т.е. по размеру ядро в 10 000 раз меньше, чем атом. Масса атома чрезвычайно мала и сосредоточена в его ядре. Обычно ее выражают в атомных единицах массы (а. е. м.).
В качестве атомной единицы массы принята |
массы атома |
|||
изотопа углерода 12 6 С.
Число протонов Z в ядре равно заряду ядра, если выражать заряд в единицах заряда электрона. Сумма числа протонов Z и числа нейтронов N равна массовому числу А , т.е. массе атома, выраженной в единицах атомных масс и округленных до целых единиц.
Существуют ядра с одним и тем же значением Z, но различным значением А , т.е. ядра с различным содержанием нейтронов N. Атомы, имеющие одинаковый заряд ядра, но разное количество
От Гость >>
А1. Число электронов во внешнем электронном слое атома с зарядом ядра +9 равно 1)1 2) 5 3)3 4) 7 А2. Металлические свойства у магния выражены сильнее, чем у 1) бериллия 2) калия 3) кальция 4) натрия A3. Веществом с ионной связью является 1) оксид cepы(VI) 2) водород 3) магний 4) фторид натрия., А4. Степени окисления железа в соединениях Fe2O3 и FeCl2 соответственно равны 1) +3 и -2 2) +3 и +3 3) +3 и +2 4) -3 и +2 А5. Кислотным оксидом является 1) SO2 2) СО 3) ZnO 4) Na2O А6. К физическим явлениям относят 1) скисание молока 2) засахаривание варенья 3) горение свечи 4) пригорание пиши А7. Какое уравнение соответствует реакции соединения? 1) NH3 + HNO3 = NH4NO3 2) H2S + MgO = MgS + H2O 3) SO3 + 2NaOH = Na2SO4 + H2O 4) CuO + H2 = Cu + H2O A8. К хорошо растворимым в воде электролитам относится 1) сульфат бария 2) сульфат цинка 3) сульфид меди(II) 4) оксид железа(III) А9. Наибольшее количество ионов аммония образуется при полной диссоциации 1 моль 1) сульфата аммония 2) сульфида аммония 3) нитрата аммония 4) фосфата аммония А10. Выделение газа происходит в результате взаимодейст¬вия ионов 1) Н+ и С1- 2) Н+ и SO32- 3) NH4+ и РО43- 4) NH4+ и S2-
Долгое время для исследователей оставались секретом многие свойства материи. Отчего одни вещества отлично проводят электричество, а другие - нет? Почему железо постепенно разрушается под воздействием атмосферы, а благородные металлы отлично сохраняются на протяжении тысяч лет? Многие из этих вопросов нашли ответ после того, как человеку стало известно устройство атома: его строение, число электронов на каждом электронном слое. Более того, освоение даже самых основ строения атомных ядер открыло миру новую эру.
Из каких элементов построен элементарный кирпичик вещества, как они взаимодействуют между собой, чем из этого мы научись пользоваться?
в представлении современной науки
В настоящее время большинство ученых склонны придерживаться планетарной модели строения материи. Согласно этой модели в центре каждого атома находится ядро, крохотное даже по сравнению с атомом (он в десятки тысяч раз мельче целого атома). Зато о массе ядра такого не скажешь. Практически вся масса атома сосредоточена именно в ядре. Ядро заряжено положительно.
Вокруг ядра вращаются электроны по различным орбитам, не круговым, как в случае с планетами Солнечной системы, а объемным (сферы и объемные восьмерки). Число электронов в атоме численно равно заряду ядра. Но рассматривать электрон как частицу, которая движется по какой-то траектории, очень сложно.

Его орбита крохотна, а скорость почти как у светового луча, поэтому правильнее рассматривать электрон вместе с его орбитой как некую отрицательно заряженную сферу.
Члены атомной семьи
Все атомы состоят из 3 составляющих элементов: протонов, электронов и нейтронов.
Протон - главный строительный материал ядра. Его вес равен атомной единице (масса атома водорода) или 1,67 ∙ 10 -27 кг в системе СИ. Заряжена частица положительно, причем заряд ее принят за единицу в системе элементарных электрических зарядов.
Нейтрон - близнец протона по массе, но никак не заряжен.
Две вышеперечисленные частицы называют нуклидами.
Электрон - противоположность протону по заряду (элементарный заряд равен −1). Но вот по весу электрон подкачал, масса его всего-то 9,12 ∙ 10 -31 кг, что почти в 2 тысячи раз легче протона или нейтрона.
Как это «разглядели»
Как можно было разглядеть строение атома, если даже самые современные технические средства не позволяют и в ближайшей перспективе не позволят получить изображения составляющих его частиц. Как же ученые узнали число протонов, нейтронов и электронов в ядре и их расположение?
Предположение о планетарном устройстве атомов было сделано на основе результатов бомбардировки тонкой металлической фольги различными частицами. На рисунке хорошо видно, как взаимодействуют с веществом различные элементарные частицы.

Число электронов, прошедших сквозь металл, в опытах равнялось нулю. Это объясняется просто: отрицательно заряженные электроны отталкиваются от электронных оболочек металла, также имеющих отрицательный заряд.
Пучок протонов (заряд +) проходил через фольгу, но с «потерями». Часть отталкивалась от попавшихся на пути ядер (вероятность таких попаданий очень незначительна), часть отклонялась от первоначальной траектории, пролетев слишком близко к одному из ядер.
Самыми «результативными» в части преодоления металла стали нейтроны. Нейтрально заряженная частица терялась только в случае прямого столкновения с ядром вещества, 99,99% же нейтронов благополучно проходили сквозь толщу металла. Кстати, размер ядер тех или иных химических элементов удалось рассчитать именно исходя из количества нейтронов на входе и не выходе.
На основе полученных данных и была построена доминирующая в настоящее время теория строения вещества, которая успешно объясняет большинство вопросов.
Чего и сколько
Число электронов в атоме зависит от порядкового номера. Так, в атоме обычного водорода имеется всего один протон. Вокруг же по орбите кружится единственный электрон. Следующий элемент периодической таблицы - гелий устроен чуточку сложнее. Его ядро состоит из двух протонов и двух нейтронов и имеет, таким образом, атомную массу 4.
С ростом порядкового номера растут размеры и масса атома. Порядковый номер химического элемента в таблице Менделеева соответствует заряду ядра (количеству в нем протонов). Число электронов в атоме равно числу протонов. Так, атом свинца (порядковый номер 82) имеет в своем ядре 82 протона. На орбитах вокруг ядра находятся 82 электрона. Чтобы рассчитать количество нейтронов в ядре, достаточно от атомной массы отнять число протонов:
Почему их всегда поровну
Любая система в нашей Вселенной стремится к стабильности. Применительно к атому это выражается в его нейтральности. Если на секунду представить, что все без исключения атомы во Вселенной обладают тем или иным зарядом разной величины с разными знаками, можно себе представить, какой бы в мире наступил хаос.

Но так как число протонов и электронов в атоме равно, итоговый заряд каждого «кирпичика» равен нулю.
Число же нейтронов в атоме - величина самостоятельная. Более того, атомы одного и того же химического элемента могут иметь различное число этих частиц с нулевым зарядом. Пример:
- 1 протон + 1 электрон + 0 нейтронов = водород (атомная масса 1);
- 1 протон + 1 электрон + 1 нейтрон = дейтерий (атомная масса 2);
- 1 протон + 1 электрон + 2 нейтрона = тритий (атомная масса 3).
В данном случае число электронов в атоме не меняется, атом остается нейтральным, изменяется его масса. Такие вариации химических элементов принято называть изотопами.
Всегда ли атом нейтрален
Нет, не всегда число электронов в атоме равно числу протонов. Если бы у атома на время нельзя было «отобрать» электрон или два, не существовало бы такого понятия, как гальваника. На атом, как на любую материю, можно воздействовать.
Под влиянием достаточно сильного электрического поля с наружного слоя атома один или несколько электронов могут «улететь». В этом случае частичка вещества перестает быть нейтральной и называется ионом. Она может передвигаться в среде газа или жидкости, перенося электрический заряд от одного электрода к другому. Таким образом запасают электрический заряд в аккумуляторных батареях, а также наносят тончайшие пленки из одних металлов на поверхности других (золочение, серебрение, хромирование, никелирование и т.д.).

Нестабильно число электронов и в металлах - проводниках электрического тока. Электроны наружных слоев как бы гуляют с атома на атом, перенося по проводнику электрическую энергию.
1)С и N 2)N и S 3)С и Si 4)He и Ne
2.Окислительная способность атомов возрастает в ряду
1)O→N→C
2)Br→Cl→F
3)S→P→Si
4)O→S→Se
3.Для какого из веществ характерна металлическая связь?
1)Na2O 2) I2 3)H2S 4)Ca
4.К неэлектролитам относят вещество,формула которого
1)H2SO3
2)H2SO4
3)NaOH
4)CH3OH
5. 2 моль катионов и 3 моль анионов образуются при полной диссоциации 1 моль
1)нитрата железа(III)
2)фосфата калия
3)ортофосфорной кислоты
4)сульфата алюминия
6.При взаимодействии каких ионов в растворе образуется слабый электролит?
1)H+ и Cl-
2)H+ и OH-
3)Na+ и Cl-
4)Na+ и OH-
7. И Zn и Mg при обычных условиях реагируют с
1)водой
2)оксидом углерода (IV)
3)соляной кислотой
4)гидроксидом алюминия
8.С оксидом фосфора (V) реагирует каждое из 2-х веществ
1)вода и углекислый газ
2)соляная кислота и оксид кальция
3)гидроксид калия и вода
4)гидроксид меди (II) и цинк
9.Соль и вода образуются в результате взаимодействия гидроксида меди (II) с
1)серой
2)водородом
3)соляной кислотой
4)сульфидом натрия
10.В реакцию с кремниевой кислотой вступает
1)фосфат калия
2)оксид углерода (IV)
3)гидроксид натрия
4)оксид фосфора (V)
11.В реакцию с раствором хлорида цинка вступает
1)Ba(OH)2 2)CuO 3)HNO3 4)Na2SO4
12.В лаборатории имеются растворы,содержащие следующие ионы:
а)Cu 2+ б) Ba 2+ в)Ag+ г)Al 3+
Для обнаружения хлорид-ионов в растворе MgCl2 используют раствор,указанный пол буквой:
1)а
2)б
3)в
4)г
13.В ряду химических элементов Te-Se-S
1)уменьшается число электронных слоев
2)усиливаются неметаллические свойства
3)уменьшается значение электроотрицательности
4)ослабевает кислотных характер высших оксидов
5)увеличивается число электронов во внешнем слое
(2 правильных ответа)
14.Оксид алюминия вступает в реакцию с
1)водой
2)железом
3)гидроксидом калия
4)азотной кислотой
5)сульфатом бария
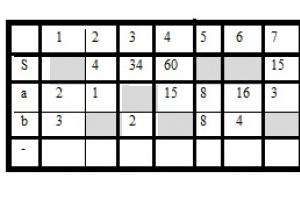
(2 правильных ответа)
15.(1 изображение)
16.(2 изображение)
17.К 170г раствора с массовой долей нитрата серебра 3% добавили избыток раствора хлорида алюминия.Вычислите массу образовавшегося осадка
Прикрепленные изображения
Ответить
Обязательный минимум знаний
Схема 1. Символика Периодической системы Д. И. Менделеева
Закономерности изменения свойств элементов и их соединений
Изменение свойств элементов и образованных ими веществ в пределах одного периода с увеличением порядкового номера элемента.1. Возрастают:
- заряд атомного ядра;
- число электронов во внешнем слое атома;
- степень окисления элементов в высших оксидах и гидроксидах (как правило, равная номеру группы);
- электроотрицательность;
- окислительные свойства;
- не
- кислотные свойства высших оксидов и гидроксидов.
2. Уменьшаются:
- радиус атома;
- металлические свойства простых веществ;
- восстановительные свойства;
- основные свойства высших оксидов и гидроксидов.
3. Не изменяется число электронных слоёв (энергетических уровней) в атоме. Изменение свойств элементов и образованных ими веществ в пределах одной А группы с увеличением порядкового номера элемента.
1. Возрастают:
- заряд атомного ядра;
- число электронных слоёв (энергетических уровней) в атоме;
- радиус атома;
- восстановительные свойства;
- металлические свойства простых веществ;
- основные свойства высших оксидов и гидроксидов;
- кислотные свойства (степень электролитической диссоциации) бескислородных кислот неметаллов.
2. Уменьшаются:
- электроотрицательность;
- окислительные свойства;
- прочность (устойчивость) летучих водородных соединений.
3. Не изменяются:
- число электронов во внешнем электронном слое атома;
- степень окисления элементов в высших оксидах и гидроксидах (как правило, равная номеру группы).
1. Наименьший радиус имеет атом
- фтора
- бериллия
- бария
- кремния
Наименьший радиус атома имеет элемент, расположенный как можно правее и как можно выше в Периодической таблице химических элементов. Этому условию отвечает фтор. Ответ: 1
2. Одинаковое число электронов на внешнем энергетическом уровне имеют атомы хлора и атомы
- марганца
- аргона
- брома
Так как одинаковое число электронов на внешнем энергетическом уровне имеют атомы элементов одной группы, то отправной точкой для выбора верного ответа явится определение группы, в которой находится хлор, - VIIA. Из предложенных вариантов этому условию соответствует бром. Ответ: 4.
3. Одинаковую электронную конфигурацию имеют атом неона и ион
- Mg 2+
- Аl 3+
Ключом к нахождению правильного ответа является определение периода, в котором находится неон, - 2-й. Следовательно, условию задания будет соответствовать катион магния. Ответ: 1.
4. Частицей, имеющей такое же строение электронной оболочки, как у атома аргона, является
- Сl +3
- Сl +1
- С1 -l
Для определения правильного ответа нужно сравнить порядковые номера аргона и хлора, как элементов одного и того же 3-го периода: № 17 и № 18. Чтобы иметь такое же строение электронной оболочки, как у атома аргона, атому хлора необходимо принять один электрон. Этому условию соответствует Cl - . Ответ: 4.
5. Число электронов в ионе А1 3+ равно
Это задание решается просто: ион алюминия по сравнению с его атомом «потерял» три электрона, следовательно, 13 - 3 = 10. Ответ: 4.
6. Высшие оксид и соответствующий ему гидроксид с наиболее выраженными основными свойствами образует
- калий
- кальций
- индий
- алюминий
Наиболее сильные оснбвные свойства проявляют оксиды и гидрооксиды щелочных металлов, т. е. элементов IA группы. Ответ: 1.
7. В порядке усиления металлических свойств элементы расположены в ряду
- Аl, Са, К
- Ва, Са, Mg
- К, Са, Ga
- Na, Mg, Аl
Так как металлические свойства наиболее выражены у щелочных металлов, то, очевидно, именно щелочной металл должен завершать искомую тройку элементов. Ответ: 1.
8. Легче всего присоединяют электроны атомы
- хлора
- селена
- брома
Присоединение электронов характеризует окислительные свойства элементов. Наиболее выражены эти свойства у элементов, имеющих большее значение номера группы и меньшее значение номера периода. Ответ: 1.
9. Высшие оксид и соответствующий ему гидроксид с наиболее выраженными кислотными свойствами образует
- фосфор
- кремний
Анализ положения предложенных в задании элементов в Периодической системе Д. И. Менделеева позволяет прийти к выводу, что все они находятся в 3-м периоде. Знание закономерностей изменения кислотно-оснбвных свойств оксидов и гидроксидов, образованных элементами одного периода, даст возможность определить верный ответ. Ответ: 3.
10. В порядке усиления неметаллических свойств простых веществ образующие их элементы расположены в ряду
- С, Si, Ge
- Se, S, О
- F, О, N
- Se, As, Ge
Это задание требует знания закономерностей изменения металлических и неметаллических свойств простых веществ, образованных химическими элементами, в периодах и группах. Анализ положения предложенных троек элементов в Периодической системе Д. И. Менделеева позволяет прийти к выводу, что варианты 1 и 2 содержат по три элемента, соответственно IV и VI групп. Однако если в первой тройке элементы расположены в порядке возрастания зарядов их атомных ядер, то во второй, наоборот, в порядке их убывания. Ответ: 2.
Остальные варианты ответов в целях экономии времени можно даже не анализировать, так как верный ответ найден.