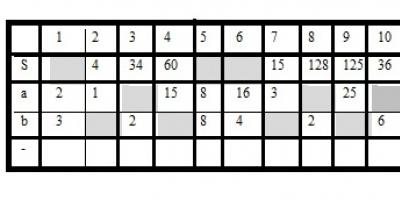
Нитриты и нитраты отличаются не только по названию, в своей формуле они имеют и разные элементы. Однако есть и то, что их «роднит». Область применения этих веществ достаточно широка. В организме человека они тоже присутствуют, причем, если их скапливается слишком много, человек получает сильное отравление, которое может привести даже к летальному исходу.
Что такое нитраты
Проще говоря, нитраты - это соли азотной кислоты. В своей формуле они содержат одноразрядный анион. Раньше нитрат именовали . Теперь так называют минералы, а также удобрения, применяемые в сельском хозяйстве.
Нитраты получаются при помощи азотной кислоты, которая воздействует на металлы, оксиды, соли и гидроксиды. Все нитраты можно развести в воде. В твердом состоянии они являются сильными окислителями, но их свойства пропадают, если в раствор добавить азотной кислоты.
Нитраты сохраняют свои свойства при обычной температуре, но при низкой температуре плавятся, причем до самого полного разложения. Процесс получения этих веществ очень сложный, поэтому будет интересен, пожалуй, только химикам.
Нитраты являются основой для взрывчатых веществ - это аммониты и иные вещества. Применяются они в основном и в качестве минеральных удобрений. Сейчас уже не существует секрета в том, что растения используют азот из соли для построения клеток своего организма. Растение создает хлорофилл, которым и живет. Но в организме людей, нитраты становятся нитритами, которые способны свести человека в могилу.
Нитриты – тоже соли
Нитриты тоже являются солями азотной кислоты, но с другой формулой в своем химическим составе. Известны натрия, нитриты кальция. Известны также нитриты свинца, серебра, щелочных, щелочноземельных, 3D-металлов.
Это кристаллические вещества, которые присущи также калию или барию. Одни вещества хорошо растворяются в воде, другие, такие как нитриты серебра, ртути или меди, плохо растворяются в ней. Примечательно, что в органических растворителях нитриты тоже практически не растворяются. Но если повысить температуру, растворимость нитритов улучшается.
Человечество использует нитриты при получении азотных красителей, для получения капролактама, а также как окисляющие и восстанавливающие реагенты в резинотехнической, текстильной и металлообрабатывающей промышленности. Например, нитрит натрия является хорошим консервантом, применяется при производстве бетонных смесей в качестве ускорителя твердения и противоморозной добавки.
Нитриты являются ядом для гемоглобина человека, поэтому их нужно ежедневно выводить из организма. Они попадают в человеческий организм или прямым путем или с какими-либо другими веществами. Если человеческий организм функционирует нормально, необходимое количество вещества остается, а ненужное – удаляется. А вот если человек болен, появляется проблема с отравлением нитритами.
Селитрой называют азотнокислые соли (нитраты) аммония, натрия, кальция и калия. В основном, они применяются в сельском хозяйстве, в качестве минеральных удобрений, и в промышленном производстве пиротехнических изделий и взрывчатых веществ.
Нитрат калия считается очень ценным удобрением, так как одновременно содержит два важных для жизни растений вещества – азот и калий. Но, в тоже время, калиевая селитра является основой черного пороха и просто незаменима при изготовлении различной пиротехники. Однако эксперименты доморощенных умельцев по созданию ракет, дымовух и прочих «взрывалок» часто заканчиваются весьма плачевно. Поэтому продажа калиевой селитры в последнее время ограничена, и дачники с наступлением весны все чаще вынуждены задумываться, как сделать селитру самостоятельно. Наш совет предназначается садоводам-любителям, использующим калиевую селитру исключительно в мирных целях.
Как сделать калиевую селитру
- Приобретите в хозяйственном магазине углекислый калий, он же поташ, и аммиачную селитру.
- Растворите их по отдельности в теплой воде, лучше дистиллированной. Используйте равные весовые части реагентов. Смешайте в ненужной посуде оба раствора, вливая раствор поташа в раствор аммиачной селитры.
- Поставьте кастрюлю на медленный огонь. Кастрюля должна быть достаточно большая, так как во время реакции смесь пенится и увеличивается в объеме. Регулярно помешивайте смесь. Вскоре из нее начнет выделяться газ аммиак с резким характерным запахом – это значит, что реакция пошла. Из-за резкого запаха газа процесс лучше проводить на улице или в помещении с хорошей вытяжкой.
- После того, как выделение газа прекратиться, снимите кастрюлю с огня, и оставьте в прохладном месте на сутки. После этого на дне образуются крупные игольчатые кристаллы калиевой селитры, которые только достать, слив жидкость, и просушить.
Аммиачная селитра одно из самых распространенных удобрений, ее вносят при посеве практически под все сельскохозяйственные культуры, как зерновые, так и овощные, а также употребляют в качестве подкормки взрослых растений. В горном деле аммиачную селитру широко используют в качестве основного компонента бризантных взрывчатых веществ – аммонала, аммонита или аммотола. Аммиачная селитра продается во всех хозяйственных магазинах в отделах «Удобрения», где ее можно легко приобрести. Изготовление аммиачной селитры в кустарных условия крайне опасно и совершенно нерентабельно! Попробовать синтезировать ее самому можно лишь в малых дозах, соблюдая все правила техники безопасности, в учебных целях.
Как сделать аммиачную селитру
- В хозяйственно магазине надо купить: нашатырный спирт, медный купорос, кальциевую селитру.
- Смешиваем нашатырный спирт с медным купоросом до получения голубого цвета раствора. В результате реакции замещения мы получим гидрооксид меди, выпавший в осадок, и сульфат аммония, остающийся в растворе.
- Сливаем раствор сульфата аммония с осадка и смешиваем его с кальциевой селитрой. В итоге, получаем сульфат кальция в виде осадка и раствор, содержащий нашу аммиачную селитру.
Мы описали основные способы получения селитры, а уж, что можно сделать из селитры, произведенной в домашних, условиях решать только вам.
Введение
Вряд ли кто-нибудь из вас ничего не слышал о нитрате натрия. Его название нередко упоминается еще в школе, не то что в промышленности. Но только название! А что еще известно про натриевую селитру? Вот о чем мы поговорим в сегодняшней статье.
ОпределениеНитрат натрия (формула NaNO 3) является натриевой солью азотной кислоты. Его могут называть "натрием азотнокислым" или "натриевой/натронной/чилийской селитрой".
Свойства
Натрий азотнокислый представлен бесцветными длинными кристаллами, имеющими ромбоэдрическую или тригональную кристаллическую решетку. На вкус они являются очень солеными. В разных веществах растворяются по-разному, но лучше всего нитрат натрия "тает" в воде. При температуре 380 о С данное соединение разлагается на азотистокислый натрий и кислород. Реакция выглядит так: 2NaNO 3 => 2NaNO 2 + O 2. Также нитрат натрия может вступать в реакции обмена, вторым реагентом которых являются соли щелочных металлов. Одним из продуктов при этом всегда будет нитрат с растворимостью, значение которой будет гораздо ниже, чем у обсуждаемого сейчас вещества. Например, при взаимодействии натриевой селитры с хлоридом калия образуется нитрат калия и поваренная соль (хлорид натрия). В расплаве обсуждаемый нитрат проявляет сильные окислительные, а в растворе - восстановительные свойства. При его разложении выделяется кислород, и благодаря этому данное соединение может вступать в реакцию с неметаллами.

Данный нитрат можно получить несколькими способами:
Реакция азотной кислоты с металлом или оксидом натрия
При добавлении в азотную кислоту чистого натрия происходит реакция нейтрализации. Продуктами ее станут искомое вещество, вода, а также газообразные азот и его оксиды (I, II). Если к этой же кислоте добавить оксид натрия, то в результате получатся обсуждаемое сейчас соединение и вода.
Реакция азотной кислоты с кислыми солями или гидроксидом натрия
Если к HNO 3 добавить кислую соль натрия (например, его гидрокарбонат), то образуются искомое вещество, вода и углекислый газ, который быстро улетучивается. Если же вторым реагентом станет гидроксид натрия, то, как в случае с его оксидом и азотной кислотой, получаются только нитрат натрия и H 2 O.
Реакция аммиачной селитры с кислыми солями или гидроксидом натрия
Азотную кислоту может с успехом заменить нитрат аммония. Во время его взаимодействия с гидроксидом натрия образуются искомое вещество, вода и газообразный аммиак, а при реакции с гидрокарбонатом натрия продуктами станут эти соединения и углекислый газ.
Реакция поваренной соли с нитратом серебра
В этом случае происходит реакция обмена, продуктами которой являются нитрат натрия и хлорид серебра.
Применение

Данное вещество используется в качестве ценного азотного удобрения. Без нитрата натрия не обходятся пиротехническая, пищевая, стекольная и металлообрабатывающая отрасли промышленности. Натриевая селитра добывается из природных залежей несколькими способами:
Выщелачивание данного вещества с помощью горячей воды и кристаллизации;
Абсорбция окислов азота с использованием раствора пищевой соды;
Реакция обмена, в которой участвуют сульфат/хлорид/карбонат натрия и кальциевая/аммиачная селитра.
Заключение
Вот какую важную роль играет азотнокислый натрий. Есть еще и другие вещества, без которых не обходится человек, но о них поговорим в другой раз.
(А) Нитриты
При условии соблюдения исключений , указанных в общих положениях к данной подгруппе, в данную товарную позицию включаются нитриты, соли металлов азотистой кислоты (HNO 2) (товарная позиция ).
- Нитрит натрия (NaNO 2). Получают восстановлением нитрата натрия свинцом и в процессе производства свинцового глета. Бесцветные кристаллы, гигроскопичные и хорошо растворимые в воде. Используется как окислитель в кубовом крашении; в органическом синтезе; для обработки мяса; в фотографии; как крысиный яд и т.п.
- Нитрит калия (KNO 2). Получают теми же способами, что и нитрит натрия, или действием диоксида серы на смесь оксида кальция и нитрата калия. Белый кристаллический порошок или желтоватые палочки; часто содержит другие соли в качестве примесей. В воде растворяется, на воздухе сильно расплывается с ухудшением свойств. Используется в тех же целях, что и нитрит натрия.
- Нитрит бария (Ва(NO 2) 2). Кристаллы, используемые в пиротехнике.
- Прочие нитриты . К ним относится нитрит аммония, неустойчивый и взрывчатый продукт; используется в виде раствора для получения азота в лаборатории.
(Б) Нитраты
При условии соблюдения исключений , указанных в общих положениях к данной подгруппе, в данную товарную позицию включаются нитраты, соли металлов и азотной кислоты (товарная позиция ), кроме нитрата аммония и нитрата натрия как чистых, так и неочищенных (товарная позиция или ). (Другие исключения см. ниже.)
Основные нитраты также включаются сюда.
- Нитрат калия (KNO 3) (также называемый "селитра"). Получают из нитрата натрия и хлорида калия. Представляет собой бесцветные кристаллы или стекловидную массу, или белый кристаллический порошок, растворимый в воде и гигроскопичный в неочищенном виде. Используется аналогично нитрату натрия, а также для получения пороха, химических детонаторов, в пиротехнике, для изготовления спичек и металлургических флюсов.
- Нитраты висмута :
(а)нейтральный нитрат висмута (Bi(NO 3) 3 ·5Н 2 О). Получается действием азотной кислоты на висмут; крупные бесцветные расплывающиеся кристаллы. Используется для получения оксидов или солей висмута и некоторых лаков;
(б)основной нитрат висмута (BiNO 3 (OН) 2). Получается из нейтрального нитрата висмута; жемчужно–белый порошок, не растворимый в воде. Используется в медицине (для лечения желудочно–кишечных заболеваний); в производстве керамики (радужные краски), в косметике, в производстве взрывателей и т.п.
- Нитрат магния (Mg(NO 3) 2 ·6Н 2 О). Бесцветные кристаллы, растворимые в воде. Используется в пиротехнике, для получения огнеупорных продуктов (с оксидом магния), калильных сеток и т.п.
- Нитрат кальция (Са(NO 3) 2). Получается при обработке дробленого известняка азотной кислотой. Белая расплывающаяся масса, растворимая в воде, спирте и ацетоне. Используется в пиротехнике, в производстве взрывчатых веществ, спичек, удобрений и т.п.
- Нитрат трехвалентного железа (Fe(NO 3) 3 ·6H 2 O или 9Н 2 О). Голубые кристаллы. Используется как протрава при крашении и печатании (в чистом виде или в смеси с ацетатом). Чистый водный раствор используется в медицине.
- Нитрат кобальта (Со(NO 3) 2 ·6Н 2 О). Пурпурные, красноватые или коричневатые кристаллы, растворимые в воде и расплывающиеся. Используется при получении кобальтовых синей или кобальтового желтого и симпатических чернил; для декорирования керамики; для электроосаждения кобальта и т.п.
- Нитрат никеля (Ni(NO 3) 2 ·6Н 2 O). Водорастворимые, расплывающиеся зеленые кристаллы. Используется в производстве керамики (коричневые пигменты); при крашении (как протрава); при электроосаждении никеля; для получения оксида никеля или чистых никелевых катализаторов.
- Нитрат двухвалентной меди (Сu(NO 3) 2). Получают растворением меди в азотной кислоте и последующей кристаллизацией (содержит 3 или 6 молекул воды в зависимости от температуры). Голубые или зеленые кристаллы, растворимые в воде, гигроскопичные; ядовитые. Используется в пиротехнике; в производстве красителей; при крашении или печатании текстильных материалов (протрава); для получения оксида двухвалентной меди и изготовления фотографической бумаги; при нанесении гальванического покрытия, для придания металлам искусственной патины и т.п.
- Нитрат стронция (Sг(NO 3) 2). Получают при действии оксида стронция или сульфида стронция на азотную кислоту при нагревании в виде безводной соли или в виде гидратированной соли (с 4 молекулами воды) при пониженных температурах. Бесцветный кристаллический порошок, расплывающийся, растворимый в воде, разлагающийся при нагревании. Используется в пиротехнике (красный свет), при изготовлении спичек.
- Нитрат кадмия (Cd(NO 3) 2 ·4Н 2 О). Получается из оксида. Бесцветные иголки, расплывающиеся, растворимые в воде. Используется как красящее вещество в керамической или стекольной промышленности.
- Нитрат бария (Ва(NO 3) 2). Получают из природного карбоната (витерита) (товарнаяпозиция ). Бесцветные или белые кристаллы или кристаллический порошок; растворимые в воде, ядовит. Используется в пиротехнике (зеленый свет); в производстве взрывчатых веществ, оптического стекла, керамических глазурей, солей бария или нитратов и т.п.
- Нитрат свинца (Рb(NO 3) 2). Нитрат свинца образуется как побочный продукт при получении диоксида свинца действием азотной кислоты на красный свинец. Бесцветные кристаллы, растворимые в воде; ядовит. Используется в пиротехнике (желтый свет), в производстве спичек, взрывчатых веществ и некоторых красящих веществ; в дублении, фотографии и литографии; для получения солей свинца, как окислитель в органическом синтезе.
Кроме указанных выше исключений , также не включаются следующие продукты.